题目内容
除去下列物质中的杂质(括号中为杂质)方法,请将相应的化学方程式填在横线上
(1)NaHCO3溶液(Na2CO3) ;
(2)Na2CO3固体(NaHCO3) ;
(3)NaCl溶液(NaHCO3) .
(1)NaHCO3溶液(Na2CO3)
(2)Na2CO3固体(NaHCO3)
(3)NaCl溶液(NaHCO3)
考点:物质的分离、提纯的基本方法选择与应用
专题:化学实验基本操作
分析:(1)Na2CO3溶液可与二氧化碳反应生成NaHCO3;
(2)NaHCO3加热分解生成碳酸钠;
(3)NaHCO3与盐酸反应生成氯化钠.
(2)NaHCO3加热分解生成碳酸钠;
(3)NaHCO3与盐酸反应生成氯化钠.
解答:
解:(1)除去NaHCO3溶液中含有的Na2CO3溶质可在溶液中通入过量二氧化碳气体,Na2CO3溶液可与二氧化碳反应生成NaHCO3,化学方程式为Na2CO3+H2O+CO2═2NaHCO3,故答案为:Na2CO3+CO2+H2O=2NaHCO3;
(2)NaHCO3加热分解生成碳酸钠,分离方法为加热,反应为2NaHCO3
Na2CO3+CO2↑+H2O,故答案为:2NaHCO3
Na2CO3+CO2↑+H2O;
(3)NaHCO3与盐酸反应生成氯化钠,则发生的反应为NaHCO3+HCl=NaCl+CO2↑+H2O,故答案为:NaHCO3+HCl=NaCl+CO2↑+H2O.
(2)NaHCO3加热分解生成碳酸钠,分离方法为加热,反应为2NaHCO3
| ||
| ||
(3)NaHCO3与盐酸反应生成氯化钠,则发生的反应为NaHCO3+HCl=NaCl+CO2↑+H2O,故答案为:NaHCO3+HCl=NaCl+CO2↑+H2O.
点评:本题考查物质分离、提纯的方法及选择,为高频考点,把握物质的性质及分离方法为解答的关键,侧重除杂的考查,注意物质的性质差异及除杂原则,题目难度不大.

练习册系列答案
相关题目
在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(g)?2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为( )
| A、67% | B、50% |
| C、25% | D、5% |
下列冶炼方法中,可将化合物中的金属元素还原为金属单质的是( )
| A、加热Al2O3 |
| B、加热CaCO3 |
| C、电解熔融NaCl |
| D、氯化钠与铝粉高温共热 |
巴豆酸的结构简式为CH3-CH=CH-COOH,现有①氯化银 ②溴水 ③纯碱溶液 ④2-丁醇 ⑤酸化的KMnO4溶液.试根据其结构特点判断在一定条件下能与巴豆酸反应的物质是( )
| A、只有②④⑤ |
| B、只有①③④ |
| C、只有①②③④ |
| D、②③④⑤ |
下列说法合理的是( )
| A、每天应保证摄入一定量的蔬菜和粗粮,是因为它们含有一定量的纤维素,用以补充营养食物中淀粉的不足 |
| B、厨房中用油不能放在盆中长时间与空气接触而被氧化,应放入大塑料桶中加盖密封保存 |
| C、人体中必需的氨基酸叫必需氨基酸 |
| D、加碘盐和铁强化酱油都有利于人体对微量元素的均衡吸收,不容易导致体内微量元素的过量 |
如图为阳离子交换膜法电解饱和食盐水原理示意图.下列说法正确的是( )

| A、从E口逸出的气体是Cl2 |
| B、每生成22.4 LCl,便产生2 mol NaOH |
| C、从B口加入含少量NaOH的水溶液以增强导电性 |
| D、电解一段时间后加适量盐酸可以恢复到电解前的浓度 |
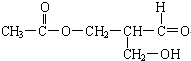 在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,以*C表示.而且,该有机化合物具有光学活性.下列有机物是否具有光学活性?
在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,以*C表示.而且,该有机化合物具有光学活性.下列有机物是否具有光学活性?