题目内容
如图所示,有以下物质相互转化关系.

试回答:
(1)写出D的化学式 ,写出H的名称 .
(2)写出由E转变成F的化学方程式 ,并用单线桥表示出电子转移的方向和数目;氧化剂是: ,还原剂是 .
(3)用KSCN溶液鉴别G溶液的现象是 ;写出向G溶液中加入A的化学反应方程式 .

试回答:
(1)写出D的化学式
(2)写出由E转变成F的化学方程式
(3)用KSCN溶液鉴别G溶液的现象是
考点:无机物的推断,常见金属元素的单质及其化合物的综合应用
专题:推断题,几种重要的金属及其化合物
分析:分析转化关系可知,A和盐酸反应生成最轻气体为氢气,说明A为金属,B为金属氯化物,B+C=E+D,转化关系中的反应现象可知E为Fe(OH)2,F为Fe(OH)3,G为FeCl3,依据G+A=B可知,B为FeCl2,B和C溶液反应生成氢氧化亚铁证明C溶液是碱溶液,C和硝酸酸化的硝酸银反应生成不是沉淀H判断为AgCl,溶液焰色反应可知是钾元素的性质,判断D为KCl,C为KOH,据此推断回答问题.
解答:
解:依据转化关系图和反应现象分析转化关系可知,A和盐酸反应生成最轻气体为氢气,说明A为金属,B为金属氯化物,B+C=E+D,转化关系中的反应现象可知E为Fe(OH)2,F为Fe(OH)3,G为FeCl3,依据G+A=B可知,B为FeCl2,B和C溶液反应生成氢氧化亚铁证明C溶液是碱溶液,C和硝酸酸化的硝酸银反应生成不是沉淀H判断为AgCl,溶液焰色反应可知是钾元素的性质,判断D为KCl,C为KOH,
(1)上述分析判断D为氯化钾溶液,化学式为KCl,H为生成的氯化银白色沉淀,
故答案为:KCl;氯化银;
(2)E转化为F的反应是氢氧化亚铁和氧气水反应生成氢氧化铁的反应,用单线桥标注氧化还原反应电子转移总数为4,得到化学方程式为: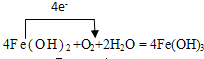 ,元素化合价降低的物质为氧化剂,氧化剂为氧气,元素化合价升高的物质为还原剂,还原剂为氢氧化铁,
,元素化合价降低的物质为氧化剂,氧化剂为氧气,元素化合价升高的物质为还原剂,还原剂为氢氧化铁,
故答案为: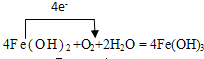 ; 氧气;氢氧化亚铁;
; 氧气;氢氧化亚铁;
(3)G为FeCl3溶液,用KSCN溶液鉴别G溶液的现象为黄色溶液氯化铁转化为血红色溶液,G和A发生的反应是氯化铁和铁发生的氧化还原反应,反应的化学方程式为:2FeCl3+Fe=3FeCl2,
故答案为:G溶液由黄色变为红色;2FeCl3+Fe=3FeCl2.
(1)上述分析判断D为氯化钾溶液,化学式为KCl,H为生成的氯化银白色沉淀,
故答案为:KCl;氯化银;
(2)E转化为F的反应是氢氧化亚铁和氧气水反应生成氢氧化铁的反应,用单线桥标注氧化还原反应电子转移总数为4,得到化学方程式为:
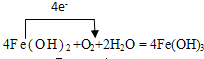 ,元素化合价降低的物质为氧化剂,氧化剂为氧气,元素化合价升高的物质为还原剂,还原剂为氢氧化铁,
,元素化合价降低的物质为氧化剂,氧化剂为氧气,元素化合价升高的物质为还原剂,还原剂为氢氧化铁,故答案为:
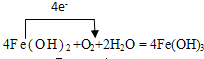 ; 氧气;氢氧化亚铁;
; 氧气;氢氧化亚铁;(3)G为FeCl3溶液,用KSCN溶液鉴别G溶液的现象为黄色溶液氯化铁转化为血红色溶液,G和A发生的反应是氯化铁和铁发生的氧化还原反应,反应的化学方程式为:2FeCl3+Fe=3FeCl2,
故答案为:G溶液由黄色变为红色;2FeCl3+Fe=3FeCl2.
点评:本题考查了物质性质和反应现象的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性.向100mL0.2mol/L的草酸溶液中加入1.68 g KOH固体,若溶液体积不变,则对所得溶液中各粒子浓度之间的关系描述正确的是( )
| A、c(C2O42-)+c(HC2O4-)+c(OH-)=c(K+)+c(H+) |
| B、c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.2mol/L |
| C、c(C2O42-)<c(HC2O4-)<c(H2C2O4) |
| D、c(H+)<c(HC2O4-)<c(C2O42-)<c(K+) |
下列说法错误的是( )
| A、分子在化学反应中可以再分,原子在化学反应中不可再分 |
| B、氧化性酸具有氧化性,还原性酸不具有氧化性 |
| C、胶体、溶液、浊液均为混合物,电解质、非电解质均为化合物 |
| D、12C、13C、14C为碳元素的三种核素,金刚石、石墨互为同素异形体 |
某溶液中存在五种离子:NO3-、SO42-、Fe3+、H+和一种未知离子,它们物质的量浓度之比为2:3:1:3:1,则未知离子可能为( )
| A、Fe2+ |
| B、Ba2+ |
| C、C1- |
| D、Mg2+ |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、11.2L H2所含的电子数为NA |
| B、3.9g 钾变为离子失去电子的数目为0.1NA |
| C、0.5mol?L-1硫酸钾溶液1L 中含有K+和SO42-离子的总数为NA |
| D、44g CO2含有的分子数为NA |

