题目内容
草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性.向100mL0.2mol/L的草酸溶液中加入1.68 g KOH固体,若溶液体积不变,则对所得溶液中各粒子浓度之间的关系描述正确的是( )
| A、c(C2O42-)+c(HC2O4-)+c(OH-)=c(K+)+c(H+) |
| B、c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.2mol/L |
| C、c(C2O42-)<c(HC2O4-)<c(H2C2O4) |
| D、c(H+)<c(HC2O4-)<c(C2O42-)<c(K+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:向100mL0.2mol/L的草酸溶液中加入1.68 g KOH固体,n(H2C2O4)=0.02mol,n(KOH)=
=0.03mol,则二者反应生成0.01molK2C2O4、0.01molKHC2O4,由KHC2O4溶液呈酸性,则混合溶液显酸性,电离大于水解,结合物料守恒及电荷守恒解答.
| 1.68g |
| 56g/mol |
解答:
解:向100mL0.2mol/L的草酸溶液中加入1.68 g KOH固体,n(H2C2O4)=0.02mol,n(KOH)=
=0.03mol,则二者反应生成0.01molK2C2O4、0.01molKHC2O4,
A.由电荷守恒可知,存在2c(C2O42-)+c(HC2O4-)+c(OH-)=c(K+)+c(H+),故A错误;
B.由草酸根中C原子守恒,可知物料守恒式为c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.2mol/L,故B正确;
C.混合溶液显酸性,电离大于水解,则c(H2C2O4)<c(HC2O4-)<c(C2O42-),故C错误;
D.溶液中有0.01molK2C2O4、0.01molKHC2O4,电离大于水解,溶液显酸性,则c(H+)<c(HC2O4-)<c(C2O42-)<c(K+),故D正确;
故选BD.
| 1.68g |
| 56g/mol |
A.由电荷守恒可知,存在2c(C2O42-)+c(HC2O4-)+c(OH-)=c(K+)+c(H+),故A错误;
B.由草酸根中C原子守恒,可知物料守恒式为c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.2mol/L,故B正确;
C.混合溶液显酸性,电离大于水解,则c(H2C2O4)<c(HC2O4-)<c(C2O42-),故C错误;
D.溶液中有0.01molK2C2O4、0.01molKHC2O4,电离大于水解,溶液显酸性,则c(H+)<c(HC2O4-)<c(C2O42-)<c(K+),故D正确;
故选BD.
点评:本题考查离子浓度大小的比较及酸碱混合计算,把握混合后溶液中溶质及量的关系为解答的关键,注意电荷守恒及物料守恒的应用,题目难度中等.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
当光束通过下列分散系时,能产生丁达尔效应的是( )
| A、NaCl溶液 |
| B、Fe(OH)3胶体 |
| C、盐酸 |
| D、硫酸铜溶液 |
已知0.02mol?L-1 CH3COOH溶液和0.01mol?L-1 NaOH溶液以等体积混和后溶液呈酸性,则该混合液中微粒浓度关系正确的( )
| A、c(CH3COO-)>c (Na+) |
| B、c(Na+)+c(H+)=c(OH-)+c(CH3COOH)+c(CH3COO-) |
| C、c(CH3COOH)>c(CH3COO-) |
| D、c(CH3COOH)+c(CH3COO-)=0.02mol?L-1 |
甘油三油酸脂是一种典型的脂肪,当它在人体内代谢时发生下列反应C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)△H=-3.35×10 4 kJ?mol-1问如以高中男生平均每人每日耗能10125.3kJ,且以完全消耗这种脂肪来计算,每天需消耗甘油三油酸脂约( )
| A、1.2mol |
| B、0.6mol |
| C、0.3mol |
| D、0.15mol |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、pH=11的溶液中:Na+、K+、HS-、ClO- |
| B、加入铝片能产生氢气的溶液中:Ba2+、K+、SO42-、HCO3- |
| C、c(H+)=c(H-)的溶液中:NH4+、Fe3+、NO3-、Cl- |
| D、c(Cu2+)=0.1mol/L的溶液中:K+、NH4+、SO42-、Br- |
下列各组离子能大量共存的是( )
| A、NaClO水溶液中:Fe2+、Cl-、Ca2+、H+ |
| B、加入KSCN显红色的溶液:K+、Na+、I-、S2- |
| C、无色酸性溶液中:K+、CH3COO-、HCO3-、MnO4- |
| D、pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
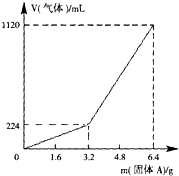 将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol?L-1盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图15所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).
将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol?L-1盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图15所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).