题目内容
20.下列关于有机物的说法正确的是( )| A. | 分子式为C5H11Cl的有机物有8种同分异构体 | |
| B. | 塑料的老化是因为其主要成分在空气中发生了缓慢的加成反应 | |
| C. | 乙醇和乙酸都能与碳酸氢钠溶液反应 | |
| D. | 富含糖类和蛋白质的物质都易被人体消化 |
分析 A.确定C5H12的同分异构体:正戊烷、异戊烷和新戊烷,然后根据各有机物的结构简式及等效H原子分别判断正戊烷、异戊烷和新戊烷中含有的一氯代物种类即可;
B.塑料的老化是因为发生了氧化反应;
C.乙醇不能与碳酸氢钠溶液反应;
D.纤维素属于糖类,但人体无法消化纤维素.
解答 解:A.分子式为C5H11Cl的同分异构体有:主链有5个碳原子:CH3CH2CH2CH2CH2Cl;CH3CH2CH2CHClCH3;CH3CH2CHClCH2CH3;主链有4个碳原子:CH3CH(CH3)CH2CH2Cl;CH3CH(CH3)CHClCH3;CH3CCl(CH3)CH2CH3;CH2ClCH(CH3)CH2CH3;主链有3个碳原子:CH2C(CH3)2CH2Cl,根据分析可知,该有机物的同分异构体总共有8种,故A正确;
B.烯塑料的老化是因为发生了氧化反应,没有发生加成反应,故B错误;
C.乙酸酸性大于碳酸,能够与碳酸氢钠溶液反应,而乙醇不与碳酸氢钠溶液反应,故C错误;
D.有的物质在人体内无法消化,如纤维素,故D错误;
故选A.
点评 本题考查有机物的组成、结构与性质,题目难度不大,明确常见有机物结构与性质为解答关键,注意掌握同分异构体的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | 胶体区别于其他分散系的本质原因是具有丁达尔效应 | |
| B. | 静电除尘除去空气中的飘尘是利用了胶体粒子的带电性 | |
| C. | 从颜色上无法区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 在江河入海处容易形成沙洲与胶体的聚沉无关 |
11.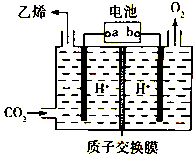 CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )
CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )
 CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )
CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )| A. | a为电池的正极 | |
| B. | 电解过程中H+移向阳极 | |
| C. | 反应前后溶液的pH保持不变 | |
| D. | 阴极反应式:2CO2+12H++12e-=C2H4+4H2O |
8.化学与社会、生产和生活息息相关.下列说法错误的是( )
| A. | 以Na2O2作供氧剂时,发生了氧化还原反应 | |
| B. | 在食品袋中放人CaCl2•6H2O,可防止食物受潮 | |
| C. | 人工合成食品级酯可以用作糖果的香料 | |
| D. | 用NH4Cl浓溶液除铁锈,因为NH4 Cl水解显酸性 |
5.已知:AgCl、AgBr及AgI的Ksp依次为1.6×10-10、4.8×10-13和1.6×10-16,现将物质的量均为1.5×10-2mol的NaI、NaBr、NaCl和4.0×10-2mo1AgNO3混合配成1.0L水溶液,达到平衡时,下列说法正确的是( )
| A. | 只生成AgBr及AgI两种沉淀 | B. | 溶液中c(I-)≈1.0×10-9mol/L | ||
| C. | 溶液中c(Br-)≈3.0×10-5mol/L | D. | 溶液中c(Ag+)≈3.2×10-8mol/L |
3.煤作为燃料有两种途径:
Ⅰ.C(s)+O2(g)═CO2(g)△H1<0
Ⅱ.C(s)+H2O(g)═CO(g)+H2(g)△H2>0
2CO(g)+O2(g)=2CO2(g△H3<0
2H2(g)+O2(g)═2H2O(g)△H4<0请回答:
(1)途径Ⅰ放出的热量=途径Ⅱ放出的热量(填“>”、“<”或“=”).
(2)△H1、△H2、△H3、△H4之间关系的数学表达式是△H1=△H2+$\frac{1}{2}$(△H3+△H4)
(3)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
试回答下列问题:
①在一个温度恒定固定容积的密闭容器中发生上述反应,反应达到平衡的标志是cd
(填序号)
a.体系的压强不再改变 b.体系的密度不再改变 c.各气体的浓度不再改变
d.各气体的质量分数不再改变 e.反应速率v(CO):v(H2)=1:1
②上述反应的正反应是放热反应(填“放热”或“吸热”);
400℃时反应H2(g)+CO2(g)?CO(g)+H2O(g)的化学平衡常数数值是0.1;
③830℃时,在2L的密闭容器中加入4mol CO(g)和6mol H2O(g)发生反应,10分钟达到平衡,此10分钟内用H2表示的平均反应速率是0.12mol/(L•min);达到平衡时CO的转化率是60%.
(4)汽车尾气净化中的一个反应如:
NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.4kJ/mol
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是C

Ⅰ.C(s)+O2(g)═CO2(g)△H1<0
Ⅱ.C(s)+H2O(g)═CO(g)+H2(g)△H2>0
2CO(g)+O2(g)=2CO2(g△H3<0
2H2(g)+O2(g)═2H2O(g)△H4<0请回答:
(1)途径Ⅰ放出的热量=途径Ⅱ放出的热量(填“>”、“<”或“=”).
(2)△H1、△H2、△H3、△H4之间关系的数学表达式是△H1=△H2+$\frac{1}{2}$(△H3+△H4)
(3)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
①在一个温度恒定固定容积的密闭容器中发生上述反应,反应达到平衡的标志是cd
(填序号)
a.体系的压强不再改变 b.体系的密度不再改变 c.各气体的浓度不再改变
d.各气体的质量分数不再改变 e.反应速率v(CO):v(H2)=1:1
②上述反应的正反应是放热反应(填“放热”或“吸热”);
400℃时反应H2(g)+CO2(g)?CO(g)+H2O(g)的化学平衡常数数值是0.1;
③830℃时,在2L的密闭容器中加入4mol CO(g)和6mol H2O(g)发生反应,10分钟达到平衡,此10分钟内用H2表示的平均反应速率是0.12mol/(L•min);达到平衡时CO的转化率是60%.
(4)汽车尾气净化中的一个反应如:
NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.4kJ/mol
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是C

1.下列有关化学用语的表示正确的是( )
| A. | NH4Cl的电子式: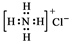 | B. | Cl-的结构示意图: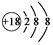 | ||
| C. | 葡萄糖的实验式:CH2O | D. | 对硝基苯酚的结构简式: |