题目内容
1.短周期主族元素X、Y、Z、W原子序数依次增大,其中r(Z)/r(X)(r表示原子半径)的值在短周期主族元素中最大.而W的核外电子总数是同族元素Y的2倍.则下列说法正确的是( )| A. | 简单离子半径:Z>Y | |
| B. | Z的单质保存在X2Y中 | |
| C. | ZYX溶液和ZXW溶液都呈碱性,且原理相同 | |
| D. | 室温下,0.01mol•L-1W的最高价含氧酸的酸式钠盐溶液的pH为2 |
分析 短周期主族元素X、Y、Z、W原子序数依次增大,其中r(Z)/r(X)(r表示原子半径)的值在短周期主族元素中最大,可知X为H,Z为Na元素;而W的核外电子总数是同族元素Y的2倍,则Y为O,W为S元素,以此来解答.
解答 解:由上述分析可知,X为H,Y为O,Z为Na,W为S,
A.具有相同电子排布的离子中原子序数大的离子半径小,则简单离子半径:Y>Z,故A错误;
B.钠与水反应,不能保存在水中,故B错误;
C.NaOH电离显碱性,NaHS水解显碱性,故C错误;
D.室温下,0.01mol•L-1W的最高价含氧酸的酸式钠盐溶液,为NaHSO4,电离出氢离子浓度为0.01mol•L-1,pH为2,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、盐类水解、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
11.常温下,向1L0.1mol•L-1CH3COONa溶液中,不断通入HCl气体.CH3COO-与CH3COOH 的变化趋势如图所示(假设HCl完全吸收且不考虑CH3COOH挥发及溶液体积变化),下列说法不正确的是( )

| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(H+)-n(OH-)=(0.05-a )mol | |
| C. | 随着HCl的加入,$\frac{c(O{H}^{-})}{c(C{H}_{3}COO{H}^{-})}$不断减小 | |
| D. | 当n(HCl)=0.1mol时,c(Cl-)>c(CH3COOH)>c(H+) |
12.下列有关硫及其化合物的说法不正确的是( )
| A. | 硫单质在过量的空气中燃烧生成SO2 | |
| B. | 自然界的硫元素主要以硫化物和硫酸盐等形式存在,无硫单质 | |
| C. | 二氧化硫和氯气使品红溶液褪色的原理不相同 | |
| D. | 浓硫酸与碳在一定条件下的反应,体现了浓硫酸的强氧化性 |
9.某学生探究如下实验(A):
(1)使淀粉变蓝的物质是I2.
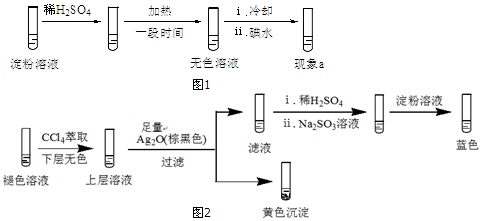
(2)分析现象ⅰ、ⅱ认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动.设计实验如图1,“现象a”证实该分析不合理:“现象a”是溶液不变蓝.
(3)再次分析:加热后单质碘发生了变化,实验如下:
Ⅰ:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝.
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝.
对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释解释1:6H++5I-+IO3-═3I2+3H2O,解释2:4H++4I-+O2═2I2+2H2O,解释3:2H++2I-+IO-═I2+H2O.
(4)探究碘水褪色后溶液的成分:
实验1:测得溶液的pH≈5
实验2:取褪色后的溶液,完成如图2实验:
①产生黄色沉淀的离子方程式是2H++2I-+Ag2O═2AgI↓+H2O.
②Ag2O的作用是证明上层溶液中存在I-,沉淀I-,排除向滤液中加入稀H2SO4后,因I-被氧化生成I2的可能.
③依据上述实验,推测滤液中含有的物质(或离子)可能是HIO(或IO-)、HIO3(或IO3-)、H+.
(5)结合化学反应速率解释实验A中现象ⅰ、现象ⅲ蓝色褪去的原因现象ⅰ:部分I2挥发,部分I2与H2O发生反应;现象ⅲ:淀粉完全水解.加热时,I2与H2O的反应速率大于淀粉水解的速率.
| 实验A | 条件 | 现象 |
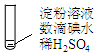 | 加热 | ⅰ.加热后蓝色褪去 ⅱ.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
(2)分析现象ⅰ、ⅱ认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动.设计实验如图1,“现象a”证实该分析不合理:“现象a”是溶液不变蓝.
(3)再次分析:加热后单质碘发生了变化,实验如下:
Ⅰ:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝.
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝.
对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释解释1:6H++5I-+IO3-═3I2+3H2O,解释2:4H++4I-+O2═2I2+2H2O,解释3:2H++2I-+IO-═I2+H2O.
(4)探究碘水褪色后溶液的成分:
实验1:测得溶液的pH≈5
实验2:取褪色后的溶液,完成如图2实验:
①产生黄色沉淀的离子方程式是2H++2I-+Ag2O═2AgI↓+H2O.
②Ag2O的作用是证明上层溶液中存在I-,沉淀I-,排除向滤液中加入稀H2SO4后,因I-被氧化生成I2的可能.
③依据上述实验,推测滤液中含有的物质(或离子)可能是HIO(或IO-)、HIO3(或IO3-)、H+.
(5)结合化学反应速率解释实验A中现象ⅰ、现象ⅲ蓝色褪去的原因现象ⅰ:部分I2挥发,部分I2与H2O发生反应;现象ⅲ:淀粉完全水解.加热时,I2与H2O的反应速率大于淀粉水解的速率.

16.下列说法不正确的是( )
| A. | 二氧化碳是酸雨的主要成分 | |
| B. | 氢气是一种理想的清洁燃料 | |
| C. | 碳酸氢钠可用于治疗胃酸过多 | |
| D. | 氯化铁溶液可用于制作印刷铜电路板 |
6.已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是( )
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡 常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
| A. | 将0.1mol/L的醋酸加水不断稀释,c(CH3COO-)始终减小 | |
| B. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离予方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| D. | 25℃,等浓度的CH3COOH、HClO、H2CO3和H2SO3溶液中,酸性最强的是HClO |
4.不能用勒沙特列原理解释的是( )
| A. | 棕红色的NO2加压后颜色先变深后变浅 | |
| B. | 由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 | |
| C. | 增大压强更有利于合成氨 | |
| D. | 硫酸工业上SO2氧化成SO3采用过量的空气 |
 .
.