题目内容
某化合物6.4g在O2中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )
| A、该化合物仅含碳、氢两种元素 |
| B、该化合物中碳、氢原子个数比为1:2 |
| C、无法确定该化合物是否含有氧元素 |
| D、该化合物中一定含有氧元素 |
考点:测定有机物分子的元素组成
专题:烃及其衍生物的燃烧规律
分析:化合物燃烧生成8.8gCO2和7.2gH2O,根据元素守恒则一定含有C、H元素,根据n=
计算二氧化碳、水的物质的量,进而计算有机物中C、H原子数目之比,根据m=nM计算C、H元素质量,根据质量守恒定律计算判断化合物中是否含有O元素.
| m |
| M |
解答:
解:化合物燃烧生成8.8gCO2和7.2gH2O,根据元素守恒则一定含有C、H元素,
8.8g二氧化碳的物质的量为:n(CO2)=
=0.2mol,n(C)=n(CO2)=0.2mol,m(C)=0.2mol×12g/mol=2.4g,
7.2g水的物质的量为:n(H2O)=
=0.4mol,n(H)=2n(H2O)=0.8mol,m(H)=0.8g,
故化合物中N(C):N(H)=0.2mol:0.4mol=1:4,
由于m(C)+m(H)=2.4g+0.8g=3.2g<6.4g,所以该化合物中一定含有氧元素,
综上分析可知,A、该化合物含碳、氢、氧元素,故A错误;
B、该化合物中碳、氢原子个数比为1:4,故B错误;
C、该化合物含有氧元素,故C错误;
D、该化合物中一定含有氧元素,故D正确.
故选D.
8.8g二氧化碳的物质的量为:n(CO2)=
| 8.8g |
| 44g/mol |
7.2g水的物质的量为:n(H2O)=
| 7.2g |
| 18g/mol |
故化合物中N(C):N(H)=0.2mol:0.4mol=1:4,
由于m(C)+m(H)=2.4g+0.8g=3.2g<6.4g,所以该化合物中一定含有氧元素,
综上分析可知,A、该化合物含碳、氢、氧元素,故A错误;
B、该化合物中碳、氢原子个数比为1:4,故B错误;
C、该化合物含有氧元素,故C错误;
D、该化合物中一定含有氧元素,故D正确.
故选D.
点评:本题考查有机物组成的确定,题目难度不大,注意根据质量守恒判断是否含有氧元素.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
异丁烷的二氯代物共有(不考虑立体异构)( )
| A、5种 | B、4种 | C、3种 | D、2种 |
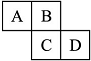 如图是元素周期表的一部分.A、B、C、D均为短周期元素,若C原子最外层电子数是其内层电子数的
如图是元素周期表的一部分.A、B、C、D均为短周期元素,若C原子最外层电子数是其内层电子数的| 3 |
| 5 |
| A、气态氢化物的稳定性:A>B |
| B、B元素的两种同素异形体常温下都是气体 |
| C、最高价氧化物对应水化物的酸性:D>C |
| D、原子半径从大到小的排列顺序为:C>B |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、6.4 gS6与S8的混合物中所含S原子数一定为0.2 NA |
| B、1 L 0.1 mol.L-1的醋酸溶液中氢离子数为0.1 NA |
| C、以惰性电极电解NaCl溶液时,每放出11.2LCl2时,则消耗NaCl个数为NA |
| D、在密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移的电子数为0.6NA |
设NA表示阿伏加德罗常数的值.下列有关说法正确的是( )
| A、在标准状况下,2.24L氮气含有共用电子对数的0.5NA |
| B、22.4g铁粉完全溶于一定浓度的硝酸中,转移的电子数可能为0.6NA |
| C、4.6g甲醇和二甲醚(CH3-O-CH3)的混合物中所含分子数等于0.1NA |
| D、含Al3+数目为0.1NA的硝酸铝溶液中,NO3-个数大于0.3NA |
同质量的下列气体中,所含原子数最少的是( )
| A、CH4 |
| B、CO2 |
| C、HCl |
| D、N2 |
能正确表示下列反应的离子方程式为( )
| A、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
| B、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| C、Mg(HCO3)2溶液与过量NaOH:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32- |
| D、次氯酸钙与亚硫酸:Ca2++2ClO-+H2SO3=CaSO3↓+2HClO |