题目内容
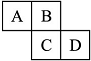 如图是元素周期表的一部分.A、B、C、D均为短周期元素,若C原子最外层电子数是其内层电子数的
如图是元素周期表的一部分.A、B、C、D均为短周期元素,若C原子最外层电子数是其内层电子数的| 3 |
| 5 |
| A、气态氢化物的稳定性:A>B |
| B、B元素的两种同素异形体常温下都是气体 |
| C、最高价氧化物对应水化物的酸性:D>C |
| D、原子半径从大到小的排列顺序为:C>B |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D均为短周期元素,根据元素在周期表中的位置知,A、B都是第二周期元素,C和D都是第三周期元素,若C原子最外层电子数是其内层电子数的
,其内层电子数是10,则最外层电子数为6,则C是S元素,根据它们的位置关系知,A是N元素、B是O元素、D是Cl元素,
A.元素的非金属性越强,其气态氢化物越稳定;
B.B的两种同素异形体是氧气和臭氧;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.同一主族元素,原子半径随着原子序数增大而减小.
| 3 |
| 5 |
A.元素的非金属性越强,其气态氢化物越稳定;
B.B的两种同素异形体是氧气和臭氧;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.同一主族元素,原子半径随着原子序数增大而减小.
解答:
解:A、B、C、D均为短周期元素,根据元素在周期表中的位置知,A、B都是第二周期元素,C和D都是第三周期元素,若C原子最外层电子数是其内层电子数的
,其内层电子数是10,则最外层电子数为6,则C是S元素,根据它们的位置关系知,A是N元素、B是O元素、D是Cl元素,
A.元素的非金属性越强,其气态氢化物越稳定,非金属性B>A,所以气态氢化物的稳定性B>A,故A错误;
B.B的两种同素异形体是氧气和臭氧,常温下二者都是气体,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性D>C,所以最高价氧化物对应水化物的酸性:D>C,故C正确;
D.同一主族元素,原子半径随着原子序数增大而减小,所以原子半径大小顺序是:C>B,故D正确;
故选A.
| 3 |
| 5 |
A.元素的非金属性越强,其气态氢化物越稳定,非金属性B>A,所以气态氢化物的稳定性B>A,故A错误;
B.B的两种同素异形体是氧气和臭氧,常温下二者都是气体,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性D>C,所以最高价氧化物对应水化物的酸性:D>C,故C正确;
D.同一主族元素,原子半径随着原子序数增大而减小,所以原子半径大小顺序是:C>B,故D正确;
故选A.
点评:本题考查元素周期表和元素周期律的综合应用,侧重考查学生知识运用能力,明确元素周期表结构是解本题关键,知道原子半径、元素非金属性等元素周期律,注意基础知识的积累,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
下列说法正确的是( )
| A、油脂、淀粉、蔗糖和葡萄糖在一定条件都能发生水解反应 |
| B、根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间 |
| C、棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| D、蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素 |
已知可用MnO2制备Cl2,下列叙述不正确的是( )
| A、氧化产物为Cl2 |
| B、氧化剂与还原剂的物质的量之比为1:4 |
| C、若有1mol Cl2生成,则反应中有2mol电子转移 |
| D、微粒的氧化性 Cl2>MnO2 |
已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A、质子数:a>c>b>d |
| B、离子的还原性:Y2->Z- |
| C、离子半径:Y2->Z->X+>W3+ |
| D、元素电负性大小顺序:Y>Z |
设NA为阿伏加德罗常数,下列叙述正确的是( )
| A、27g铝的原子最外层电子总数为NA |
| B、2.8 g N2和2.8 g CO所含电子数均为1.4NA |
| C、1L0.1mol?L-1乙酸溶液中H+数为0.1NA |
| D、标准状况下,22.4L乙醇的分子数为NA |
某化合物6.4g在O2中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )
| A、该化合物仅含碳、氢两种元素 |
| B、该化合物中碳、氢原子个数比为1:2 |
| C、无法确定该化合物是否含有氧元素 |
| D、该化合物中一定含有氧元素 |
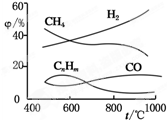 我国正在兴起新能源汽车,其中以甲烷为燃料的汽车,能有效降低碳的排放、降低污染.如图为密闭加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知( )
我国正在兴起新能源汽车,其中以甲烷为燃料的汽车,能有效降低碳的排放、降低污染.如图为密闭加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知( )| A、煤只含有碳、氢、氧三种元素 |
| B、煤中所含的有机物是CH4、CnHm、CO |
| C、温度在580~600℃范围内,CH4、CnHm分解不会生成CO |
| D、800℃以后CnHm分解生成了甲烷和氢气 |
 根据图示装置,下列说法不正确的是( )
根据图示装置,下列说法不正确的是( )