题目内容
16. 图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极.接通电路后,发现B上的c点为红色.试回答:
图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极.接通电路后,发现B上的c点为红色.试回答:(1)电源A上的b为负极.
(2)写出c、e两极的电极反应式.
(3)通电一段时间后,c、d、e、f 各极的电解产物的物质的量之比为2﹕2﹕1﹕2.
分析 A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,发现c点显红色,则c点发生2H++2e-=H2↑,所以c为阴极,电源上b为负极,C中发生2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,f上生成氢气,硫酸浓度变大,pH减小,以此来解答.
解答 解:(1)发现c点显红色,则c点发生2H++2e-=H2↑,所以c为阴极,电源上b为负极,故答案为:负;
(2)c为阴极,电解氯化钠溶液时c点发生2H++2e-=H2↑,e为阳极,电解硫酸溶液相对于电解水,e电极反应式为4OH--4e-=2H2O+O2↑,
故答案为:2H++2e-=H2↑;4OH--4e-=2H2O+O2↑;
(3)c、d、e、f 各极的电极反应式分别为2H++2e-=H2↑,2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,2H++2e-=H2↑,据电子守恒可知,各极的电解产物的物质的量之比为2﹕2﹕1﹕2,故答案为:2﹕2﹕1﹕2.
点评 本题考查电解原理,明确c点显红色是解答本题的突破口,熟悉发生的电极反应即可解答,题目难度不大.

练习册系列答案
相关题目
15.具有下列电子排布式的原子中,半径最大的是( )
| A. | ls22s22p63s23p5 | B. | 1s22s22p63s23p2 | C. | 1s22s22p2 | D. | 1s22s22p63s23p4 |
11. 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸
(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)

已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g.
实验流程:
①往装置A中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热.
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品.
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如表所示.
请回答:
(1)装置A的名称三颈烧瓶.若不用温度计,本实验控制反应温度的措施为沸水浴加热.
(2)白色粗产品中除了KCl外,其他可能的无机杂质为MnCl2.
(3)操作②中趁热过滤的目的是防止苯甲酸结晶析出,减少其损失,操作I的名称过滤、干燥.
(4)步骤③中用到的定量仪器有分析天平,100mL容量瓶,50mL酸式、碱式滴定管.
(5)样品中苯甲酸纯度为96.00%.
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将偏小(填“偏大”、“偏小”或“不变”).
 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)

已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g.
实验流程:
①往装置A中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热.
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品.
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如表所示.
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(1)装置A的名称三颈烧瓶.若不用温度计,本实验控制反应温度的措施为沸水浴加热.
(2)白色粗产品中除了KCl外,其他可能的无机杂质为MnCl2.
(3)操作②中趁热过滤的目的是防止苯甲酸结晶析出,减少其损失,操作I的名称过滤、干燥.
(4)步骤③中用到的定量仪器有分析天平,100mL容量瓶,50mL酸式、碱式滴定管.
(5)样品中苯甲酸纯度为96.00%.
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将偏小(填“偏大”、“偏小”或“不变”).
8.下列制定微粒的数目相等的是( )
| A. | 等n的水与重水含有的中子数 | |
| B. | 等n的铁分别与足量氯气和硫完全反应时转移的电子数 | |
| C. | 等m的乙烯和丙烯中含有的共用电子对数 | |
| D. | 同温、同压同体积的CO和NO含有的质子数 |
5.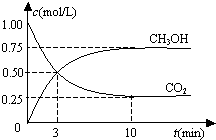 恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得其中CO2和CH3OH(g)浓度随时间变化如图.下列说法错误的是( )
 恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得其中CO2和CH3OH(g)浓度随时间变化如图.下列说法错误的是( )
| A. | 该密闭容器的体积为1 L | |
| B. | 反应达平衡,氢气的转化率为0.75 | |
| C. | 反应达平衡,氢气平均反应速率0.075 mol/(L•min) | |
| D. | CO2或H2O物质的量不再改变时反应达平衡 |
6.一种化学冰袋中含有Na2SO4•10H2O和NH4NO3,将它们混合并用手搓揉就可制冷,且制冷效果能维持一段时间.以下关于其制冷原因的推测,肯定错误的是( )
| A. | Na2SO4•10H2O脱水是吸热过程 | |
| B. | 较长时间制冷是由于Na2SO4•10H2O脱水是较慢的过程 | |
| C. | 铵盐在该条件下,发生的复分解反应是吸热反应 | |
| D. | NH4NO3溶于水会吸收热量 |
 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物. .
. 、
、 .
. ,试写出有关化学反应方程式:CH≡CH+HCl$→_{△}^{催化剂}$CH2=CHCl,nCH2=CHCl$\stackrel{一定条件}{→}$
,试写出有关化学反应方程式:CH≡CH+HCl$→_{△}^{催化剂}$CH2=CHCl,nCH2=CHCl$\stackrel{一定条件}{→}$ .
.
