题目内容
5. 恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
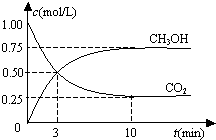
恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得其中CO2和CH3OH(g)浓度随时间变化如图.下列说法错误的是( )
| A. | 该密闭容器的体积为1 L | |
| B. | 反应达平衡,氢气的转化率为0.75 | |
| C. | 反应达平衡,氢气平均反应速率0.075 mol/(L•min) | |
| D. | CO2或H2O物质的量不再改变时反应达平衡 |
分析 A.根据充入1mol CO2和3mol H2,结合图象开始的CO2浓度为1mol/L计算体积;
B.根据氢气的转化率=$\frac{转化量}{起始量}$继续计算;
C.根据反应速率v=$\frac{△c}{△t}$计算v(CO2),再根据速率之比等于化学计量数之比计算v(H2);
D.CO2或H2O物质的量不再改变,即正逆反应速率相等.
解答 解:A.因为开始充入1mol CO2和3mol H2,根据图象开始的CO2浓度为1mol/L,所以该密闭容器的体积为1 L,故A正确;
B.根据图象开始的CO2浓度变化为1-0.25=0.75mol/L,所以根据CO2(g)+3H2(g)?CH3OH(g)+H2O(g),氢气的浓度变化为0.75×3=2.25mol/L,所以氢气的转化率=$\frac{转化量}{起始量}$=$\frac{2.25}{3}$=0.75,故B正确;
C.从反应开始到平衡,v(CO2)=$\frac{1mol/L-0.25mol/L}{10min}$=0.075mol•L-1•min-1,速率之比等于化学计量数之比,故v(H2)=3×0.075mol•L-1•min-1=0.225 mol•L-1•min-1,故C错误;
D.CO2或H2O物质的量不再改变,即正逆反应速率相等,则反应达平衡,故D正确;
故选C.
点评 本题考查化学平衡图象及其相关计算等,难度中等,注意利用图象进行计算判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2,在该反应中( )
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1 mol Na2S2O3,转移4 mol电子 | |
| D. | 相同条件下,每吸收10 m3SO2就会放出2.5 m3CO2 |
20.下列各种说法不正确的是( )
| A. | 仅用溴水一种试剂可将苯、己烯、乙醇、四氯化碳、亚硫酸钠溶液五种物质鉴别开来 | |
| B. | Na2O2中既含离子键又含共价键,其所含的阳离子对阴离子的个数比为2:1 | |
| C. | 甲烷、新戊烷与2,2,3,3-四甲基丁烷的一氯代物均只有一种 | |
| D. | 硬脂酸(C17H35COOH)与乙酸、甲醇与乙二醇(HOCH2CH2OH)均互为同系物关系 |
10.下列选项的离子方程式所对应的化学反应正确的是( )
| 选项 | 离子方程式 | 所对应的化学反应 |
| A | HCO3-+OH-+Ca2+═CaCO3↓+H2O | 既可以表示少量NaHCO3与过量石灰水反应,也可以表示少量NaOH与过量Ca(HCO3)2反应 |
| B | H++OH-═H2O | 代表任何强酸与强碱反应 |
| C | Fe+2H+═Fe2++H2↑ | 代表铁与所有强酸反应 |
| D | Al3++4NH3•H2O═4NH4++AlO2-+2H2O | 代表可溶性铝盐与过量氨水反应 |
| A. | A | B. | B | C. | C | D. | D |
17.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)•cn(Bm-),称为难溶电解质的溶度积.已知下表数据:
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 | |
| B. | 该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4 | |
| C. | 向该溶液中加入适量氯水,并调节pH到3~4后过滤,可获得纯净的CuSO4溶液 | |
| D. | 在pH=5的溶液中Fe3+不能大量存在 |
14.下列冶炼金属的反应原理,错误的是( )
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | ||
| C. | 3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe | D. | Cu+2FeCl3═CuCl2+2FeCl2 |

 图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极.接通电路后,发现B上的c点为红色.试回答:
图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极.接通电路后,发现B上的c点为红色.试回答: