题目内容
16.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列事实能说明上述观点的是( )| A. | 乙酸易溶于水,而乙烷难溶于水 | |
| B. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| C. | 甲苯能使高锰酸钾溶液褪色,甲烷和苯不能使高锰酸钾溶液褪色 | |
| D. | 乙醛与Ag(NH3)2 OH 1:2 反应.而甲醛为 1:4 |
分析 A.羧基能与水形成氢键;
B.根据C=C官能团的性质分析;
C.苯环影响甲基,甲苯易被氧化;
D.甲醛可以看成含有2个醛基;
解答 解:A.乙酸能与水形成氢键,易溶于水,而乙烷不能形成氢键,难溶于水,不能用上述观点证明,故A不选;
B.乙烯和乙烷结构不同,乙烯含有C=C,可发生加成反应,不能用上述观点证明,故B不选;
C.苯环影响甲基,甲苯易被高锰酸钾氧化,而甲烷和苯不能使高锰酸钾溶液褪色,可说明原子间(或原子与原子团间)的相互影响,故C选;
D.乙醛与Ag(NH3)2 OH 1:2 反应,甲醛可以看成含有2个醛基,所以甲醛为与Ag(NH3)2 OH 1:4反应,不能用上述观点证明,故D不选;
故选C.
点评 本题考查有机物的结构和性质,题目难度不大,注意有机物的原子团之间相互影响的特点.

练习册系列答案
相关题目
6.科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )
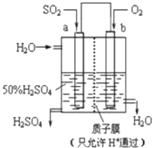

| A. | a为正极,b为负极 | |
| B. | 生产过程中H+向a电极区域运动 | |
| C. | 电子从b极向a极移动 | |
| D. | 负极反应式为:2H2+SO2-2e-=SO42-+4H+ |
4.根据元素周期律及物质结构的有关知识,以下有关排序正确的是( )
| A. | 稳定性:HCl>H2S>H2O | B. | 酸性:HClO4>HNO3>H3PO4 | ||
| C. | 还原性:HCl>HBr>HI | D. | 碱性:NaOH>Mg(OH)2>Ba(OH)2 |
11.X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的( )
| X | Y | ||
| Z | W |
| A. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| B. | 原子半径由小到大的顺序为:X<Z<Y<W | |
| C. | 与同浓度的盐酸反应,Z比W更剧烈 | |
| D. | X的氧化物是碱性氧化物 |
1.下列叙述正确的是( )
| A. | 碱性氧化物一定是金属氧化物 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 酸分子中有几个H原子即为几元酸 | |
| D. | 盐电离时,只生成一种阳离子,一种阴离子 |
3.已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量下列叙述正确的是( )
| A. | 氢气和氯气反应生成氯化氢气的热化学方程式是H2(g)+Cl2(g)=2HCl(g) | |
| B. | 氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183 kJ•mol-1 | |
| C. | 氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183 kJ•mol-1 | |
| D. | 氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183 kJ•mol-1 |
4.在直流电的作用下,锌板上镀铜时,金属铜作( )
| A. | 阳极 | B. | 阴极 | C. | 正极 | D. | 负极 |
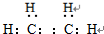 ,B的结构简式
,B的结构简式 或
或 .
.