题目内容
15.某有机物的分子式为C3H7O2N,关于它的叙述不正确的是( )| A. | 该分子可能是天然蛋白质水解的产物 | |
| B. | 该分子核磁共振氢谱图可能有两个吸收峰,且面积之比为1:6 | |
| C. | 该分子只有2种同分异构体 | |
| D. | 分子中可能含有个一个羟基 |
分析 A.C3H7O2N可能是丙氨酸;
B.根据峰的种类等于氢原子种类,峰面积之比等于个数之比;
C.同分异构体可能是氨基酸,也可能是硝基化合物等;
D.分子中可能为CH2OHCONHCH3;
解答 解:A.该分子可能是天然蛋白质水解的产物丙氨酸,故A正确;
B.该分子结构简式可能为:CH3CH(NO2)CH3,核磁共振氢谱图可能有两个吸收峰,且面积之比为1:6,故B正确;
C.该分子若为氨基酸,有2种结构,若为硝基化合物,有2种结构,同分异构体数目大于4种,故C错误;
D.分子中可能为CH2OHCONHCH3,分子中含有个一个羟基,故D正确;
故选C.
点评 本题主要考查了有机物的结构与同分异构体,难点是同分异构体种类的判断,题目难度中等.

练习册系列答案
相关题目
5.分别用等质量的金属钠进行下列实验,其中生成氢气的体积(同温同压)最大的是( )
| A. | 将钠投入到足量水中 | |
| B. | 将钠用铝箔包好并刺一些小孔,再放入足量水中 | |
| C. | 将钠放入足量稀硫酸中 | |
| D. | 将钠放入足量氢氧化钠溶液中 |
6.清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG).其主要成分都是( )
| A. | 氢气 | B. | 碳水化合物 | C. | 碳氢化合物 | D. | 醇类 |
3.解放日报12月13日报道,甘肃发现亿吨级大油田,石油是一种重要的能源.下列关于石油的说法正确的是( )
| A. | 石油不溶于水密度比水大 | B. | 石油中主要含有碳、氢两种元素 | ||
| C. | 石油的裂化属于物理变化 | D. | 石油分馏获得的各馏分是纯净物 |
10.在中和滴定实验中,下列仪器中不会用到的是( )
| A. |  | B. |  | C. |  | D. |  |
20.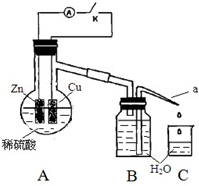 某同学分析Zn 与稀H2SO4的反应.
某同学分析Zn 与稀H2SO4的反应.
(1)该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(2)制H2时,用稀硫酸而不用浓硫酸,原因是浓H2SO4具有强氧化性,不能生成氢气.
(3)已知:Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-332kJ/mol
ZnO(s)+H2SO4(aq)═ZnSO4(aq)+H2O(l)△H=-112kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol 则Zn 与稀H2SO4反应生成1mol H2时的反应热△H=kJ/mol.
(4)该同学用如下装置进行实验,分析影响反应速率的因素.
实验时,从断开K 开始,每间隔1 分钟,交替断开或闭合K,并连续计数每1 分钟内从a 管流出的水滴数,得到的水滴数如下表所示:
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K 时比断开K 时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K 时的反应速率快于闭合K 时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112 的主要原因是断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
 某同学分析Zn 与稀H2SO4的反应.
某同学分析Zn 与稀H2SO4的反应.(1)该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(2)制H2时,用稀硫酸而不用浓硫酸,原因是浓H2SO4具有强氧化性,不能生成氢气.
(3)已知:Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-332kJ/mol
ZnO(s)+H2SO4(aq)═ZnSO4(aq)+H2O(l)△H=-112kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol 则Zn 与稀H2SO4反应生成1mol H2时的反应热△H=kJ/mol.
(4)该同学用如下装置进行实验,分析影响反应速率的因素.
实验时,从断开K 开始,每间隔1 分钟,交替断开或闭合K,并连续计数每1 分钟内从a 管流出的水滴数,得到的水滴数如下表所示:
| 1 分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1 分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
①由水滴数58>34、81>59,说明在反应初期,闭合K 时比断开K 时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K 时的反应速率快于闭合K 时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112 的主要原因是断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
7.标准状况下0.05mol某一无色可燃气体在足量氧气中完全燃烧.若将产物通过足量的澄清石灰水中,得到的白色沉淀为0.15mol;若用足量碱石灰吸收燃烧产物,增重9.3g.
(1)计算燃烧产物中水的质量.
(2)此气体的化学式是C3H6.
(3)写出表示此气体燃烧热的热化学方程式C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1411kJ/mol.
| 可能用到的燃烧热 | C2H4 | C3H6 | C3H8 |
| 单位/kJ•mol-1 | 1411 | 2092 | 2220 |
(2)此气体的化学式是C3H6.
(3)写出表示此气体燃烧热的热化学方程式C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1411kJ/mol.
2. 如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )
如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )
 如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )
如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )| A. | 该反应的热化学方程式为 N2(g)+3H2(g)?2NH3(g),△H=-192kJ•mol-1 | |
| B. | 不用催化剂,生成 1molNH3放出的热量为92kJ | |
| C. | 曲线b表明加入催化剂,反应热减小 | |
| D. | 曲线b表明加入催化剂,反应速率加快 |
3.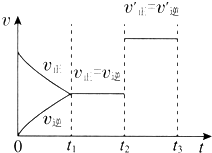 如图表示一定条件下N2+3H2?2NH3的反应速率和时间的关系,其中t1是达到平衡需要的时间,t2~t3是改变一个条件后出现的情况,则该条件可能是( )
如图表示一定条件下N2+3H2?2NH3的反应速率和时间的关系,其中t1是达到平衡需要的时间,t2~t3是改变一个条件后出现的情况,则该条件可能是( )
 如图表示一定条件下N2+3H2?2NH3的反应速率和时间的关系,其中t1是达到平衡需要的时间,t2~t3是改变一个条件后出现的情况,则该条件可能是( )
如图表示一定条件下N2+3H2?2NH3的反应速率和时间的关系,其中t1是达到平衡需要的时间,t2~t3是改变一个条件后出现的情况,则该条件可能是( )| A. | 加压 | B. | 升温 | C. | 加入催化剂 | D. | 增大反应物浓度 |