题目内容
17.已知反应2HI(g)═H2(g)+I2(g)△H=+11kJ•mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.分析 正反应为吸热反应,化学键断裂时需吸收的能量-化学键生成时需放出的能量=反应吸收的热量,以此解答该题.
解答 解:设1molHI(g)分子中化学键断裂时需吸收的能量为x kJ,则:2x kJ-436kJ-151kJ=11kJ,解得x=299,
故答案为:299.
点评 本题考查反应热计算,为高频考点,侧重考查学生自学能力、分析解决问题的能力,注意把握键能与反应热的计算,难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
5.三氯化六氨合钴(Ⅲ)是一种重要的配合物原料,实验室制备三氯化六氨合钴(Ⅲ)的化学方程式为:
2CoCl2•6H2O+10NH3+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+14H2O
实验流程如图1:
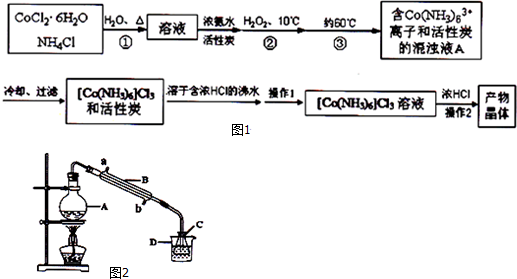
已知:[Co(NH3)6]Cl3 在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
请回答下列问题:
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2•6H2O晶体,加热煮沸和研细的目的是加速固体溶解.
(2)H2O2的作用是做氧化剂,第③步中保持60℃的加热方法是水浴加热.
(3)过滤是滤纸先用蒸馏水湿润,然后用玻璃棒压实滤纸,排出滤纸与漏斗之间的气泡.
(4)实验操作1为趁热过滤,[Co(NH3)6]Cl3 溶液中加入浓HCl的目的是有利于[Co(NH3)6]Cl3析出,提高产率.
(5)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:
[Co(NH3)6]Cl3+3NaOH═Co(OH)3↓+6NH3↑+3NaCl(装置见图2),
C中装0.5000mol/L的盐酸25.00mL,D中装有冰水.加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,加入2~3滴甲基红指示剂,用0.5000mol/L的NaOH滴定.已知:
①仪器A的名称是圆底烧瓶.
②当滴定到终点时,共需消耗NaOH溶液13.00mL(精确到0.01mL)
③若用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将偏大(填“偏大”、“偏小”或“不变”).
2CoCl2•6H2O+10NH3+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+14H2O
实验流程如图1:

已知:[Co(NH3)6]Cl3 在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
| 温度(℃) | 0 | 20 | 47 |
| 溶解度(g) | 4.26 | 6.96 | 12.74 |
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2•6H2O晶体,加热煮沸和研细的目的是加速固体溶解.
(2)H2O2的作用是做氧化剂,第③步中保持60℃的加热方法是水浴加热.
(3)过滤是滤纸先用蒸馏水湿润,然后用玻璃棒压实滤纸,排出滤纸与漏斗之间的气泡.
(4)实验操作1为趁热过滤,[Co(NH3)6]Cl3 溶液中加入浓HCl的目的是有利于[Co(NH3)6]Cl3析出,提高产率.
(5)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:
[Co(NH3)6]Cl3+3NaOH═Co(OH)3↓+6NH3↑+3NaCl(装置见图2),
C中装0.5000mol/L的盐酸25.00mL,D中装有冰水.加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,加入2~3滴甲基红指示剂,用0.5000mol/L的NaOH滴定.已知:
| 指示剂 | 颜色 | 变色的pH范围 | ||
| 甲基红 | 红 | 橙 | 黄 | 4.4~6.2 |
②当滴定到终点时,共需消耗NaOH溶液13.00mL(精确到0.01mL)
③若用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将偏大(填“偏大”、“偏小”或“不变”).
6.下列过程中△H小于零的是( )
| A. | 炽热的碳与二氧化碳的反应 | B. | 氯化铵分解得氨气 | ||
| C. | 碳酸钙分解得二氧化碳 | D. | Zn与硫酸的反应 |
7.图I 是NO2(g)+CO(g)?CO2(g)+NO(g)反应过程中能量变化的示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态.当改变其中一个条件X,Y随X的变化关系曲线如图II所示.

下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 一定条件下,向密闭容器中加入1molNO2(g)与1molCO(g)反应放出234kJ热量 | |
| B. | 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 | |
| C. | 若X表示反应时间,则Y表示的可能是混合气体的密度 | |
| D. | 若X表示温度,则Y表示的可能是CO2的物质的量浓度 |
 一硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯).反应原理:
一硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯).反应原理:

 .
.