题目内容
13.下列对应化学反应的离子方程式书写正确的是( )| A. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 铁在氯气中燃烧:2Fe+3Cl2═2Fe3++6Cl- | |
| C. | 硫酸铜溶液中滴加氢氧化钡溶液:SO42-+Ba2+═BaSO4↓ | |
| D. | 氧化铝与稀盐酸混合:Al2O3+6H+═2Al3++3H2O |
分析 A.离子方程式两边正电荷不相等,违反了电荷守恒;
B.该反应不是发生在溶液中的反应,不能书写离子方程式;
C.漏掉了铜离子与氢氧根离子生成氢氧化铜沉淀的反应;
D.氧化铝与盐酸反应生成氯化铝和水.
解答 解:A.铜与硝酸银溶液反应生成硝酸铜和银单质,正确的离子方程式为:Cu+2Ag+═Cu2++2Ag,故A错误;
B.铁在氯气中燃烧,反应的化学方程式为:2Fe+3Cl2═$\frac{\underline{\;点燃\;}}{\;}$2Fe3Cl3,无法书写离子方程式,故B错误;
C.硫酸铜溶液中滴加氢氧化钡溶液,反应生成硫酸钡和氢氧化铜沉淀,正确的离子方程式为:SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓,故C错误;
D.氧化铝与稀盐酸混合,二者反应生成氯化铝和水,反应的离子方程式为:Al2O3+6H+═2Al3++3H2O,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
3.某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是( )
| A. | FeCl2 | B. | Na2O2 | C. | SO3 | D. | SiO2 |
4.下表符号中“2”的含义正确的一组是( )
| 2H | 2He | 2Cl | Ca2+ | |
| A | 质量数 | 中子数 | 质子数 | 电荷数 |
| B | 质量数 | 质子数 | 原子个数 | 电荷数 |
| C | 质子数 | 中子数 | 原子个数 | 电荷数 |
| D | 质量数 | 质子数 | 中子数 | 电荷数 |
| A. | A | B. | B | C. | C | D. | D |
1.将5.6g铁粉放入一定量某浓度的硝酸溶液中,待铁粉全部溶解后,共收集到NO、NO2(其他气体忽略不计)混合气体0.15mol,该混合气体中NO与NO2的体积比可能是( )
| A. | 1:1 | B. | 2:1 | C. | 3:2 | D. | 3:1 |
8.下列实验操作能够达到实验目的是( )
| A. | 从溴水中提纯单质溴的方法是:先用CCl4萃取,分液后再蒸馏 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 用盛NaOH溶液的洗气瓶除去CO2中混有的HCl气体 | |
| D. | 在实验室里,用澄清的石灰水和氯化铵溶液混合制取氨气 |
18.可逆反应mA(s)+nB(g)?pC(g)+qD(g)△H=Q kJ•mol-1在反应过程中,当其它条件不变时,C的体积分数Φ(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示.下列叙述正确的是( )
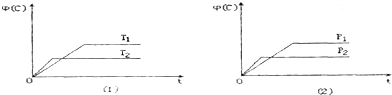

| A. | T1>T2 P1>P2 | B. | Q>0 | ||
| C. | m+n<p+q | D. | 该反应一定具有自发性 |
5.下列叙述或离子方程式书写正确的是( )
| A. | 将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+3ClO-═SO42-+Cl-+2HClO | |
| B. | 向含有Fe2O3悬浊液中通入HI气体:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:Ba2++2OH-+2NH4++SO42-═BaSO4↓+2NH3•H2O |
2.下列叙述不正确的是( )
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 二氧化硅是生产光导纤维的重要原料 | |
| D. | 稀HNO3和活泼金属反应时不能得到氢气 |
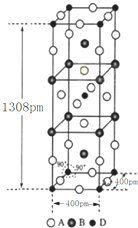 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题: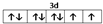 .
.