题目内容
18.可逆反应mA(s)+nB(g)?pC(g)+qD(g)△H=Q kJ•mol-1在反应过程中,当其它条件不变时,C的体积分数Φ(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示.下列叙述正确的是( )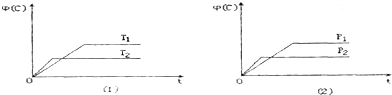
| A. | T1>T2 P1>P2 | B. | Q>0 | ||
| C. | m+n<p+q | D. | 该反应一定具有自发性 |
分析 由左图知,升高温度,的体积分数Φ(C)减小,则平衡向逆向移动,升高温度平衡向吸热反应移动,故正反应为放热反应;由右图可知,压强为P2先到达平衡,故P2>P1,增大压强,分数Φ(C)减小,则平衡向逆向移动,增大压强平衡向体积减小的方向移动,故n<p+q,由此分析解答.
解答 解:A、由左图知,温度T2先到达平衡,故T2>T1,由右图可知,压强为P2先到达平衡,故P2>P1,故A错误;
B、升高温度,的体积分数Φ(C)减小,则平衡向逆向移动,升高温度平衡向吸热反应移动,故正反应为放热反应,所以Q<0,故B错误;
C、P2>P1,增大压强,分数Φ(C)减小,则平衡向逆向移动,增大压强平衡向体积减小的方向移动,故n<p+q,故C错误;
D、正反应是放热反应,△H<0,△S>0,所以△G<0,所以应一定具有自发性,故D正确;
故选D.
点评 图象的解题方法是“先拐先平”,即曲线先折拐的首先达到平衡,以此判断温度或压强的高低,再依据外界条件对平衡的影响确定答案.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
8.下列关于浓硫酸和浓硝酸的叙述正确的是( )
| A. | 浓硫酸和浓硝酸常温下均可以与Cu迅速反应 | |
| B. | 浓硫酸和浓硝酸长期露置在空气中浓度均会增大 | |
| C. | 常温下浓硫酸和浓硝酸均不能用铝制容器贮存 | |
| D. | 浓硫酸和浓硝酸均具有强氧化性 |
6.下列分子中,属于极性分子的是( )
| A. | N2 | B. | O2 | C. | NH3 | D. | CO2 |
13.下列对应化学反应的离子方程式书写正确的是( )
| A. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 铁在氯气中燃烧:2Fe+3Cl2═2Fe3++6Cl- | |
| C. | 硫酸铜溶液中滴加氢氧化钡溶液:SO42-+Ba2+═BaSO4↓ | |
| D. | 氧化铝与稀盐酸混合:Al2O3+6H+═2Al3++3H2O |
3. 下图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
下图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
 下图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
下图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 升高温度 | B. | 加大N的投入量 | C. | 添加催化剂 | D. | 加大X的投入量 |
10.下列各物质,能由单质间发生化合反应得到,但不能由单质与酸发生置换反应得到的是( )
| A. | MgCl2 | B. | FeCl2 | C. | AlCl3 | D. | CuCl2 |
7.下列变化不可能通过一步反应直接完成的是( )
| A. | Al2O3→Al(OH)3 | B. | Na→Na2O2 | C. | Fe(OH)2→Fe(OH)3 | D. | Al(OH)3→AlO2- |
18.用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )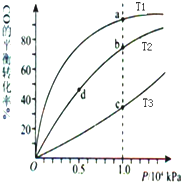

| A. | 温度:T1>T2>T3 | B. | 平衡常数:K(a)>K(c) K(b)=K(d) | ||
| C. | 正反应速率:v(a)>v(c) v(b)>v(d) | D. | 平均摩尔质量:M(a)<M(c) M(b)>M(d) |