题目内容
9.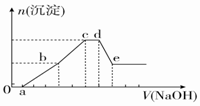 向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1mol•L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.下列有关说法正确的是( )
向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1mol•L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.下列有关说法正确的是( )| A. | 在0~a段加入的NaOH溶液与NH4Cl反应 | |
| B. | 在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3 | |
| C. | c点溶液中溶质只有NaCl | |
| D. | 在d~e段加入NaOH溶液发生反应的离子方程式为Al3++4OH-═AlO2-+2H2O |
分析 A.0~a段加入的NaOH溶液与HCl的反应;
B.对应的电解质越难电离,越易与OH-反应,五种微粒中,能与OH-反应的有H+,Al3+,Mg2+,NH4+,Al(OH)3其中H+最易与OH-反应,其次为Al3+,Mg2+,反应后生成水、氢氧化铝和氢氧化镁,接着是NH4+,最后溶解Al(OH)3;
C.0~a段加入的NaOH溶液与HCl的反应生成NaCl和水,在.a~c段的混合溶液中加入NaOH溶液,发生反应Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,至c点时Mg2+,Al3+恰好完全沉淀,溶液中还有未反应的NH4Cl,故溶液中的溶质只有NaCl,NH4Cl;
D.d~e段加入的NaOH溶液发生的反应为Al(OH)3+OH-=AlO-2+H2O.
解答 解:A.0~a段加入的NaOH溶液与HCl的反应,故A错误;
B.对应的电解质越难电离,越易与OH-反应,五种微粒中,能与OH-反应的有H+,Al3+,Mg2+,NH4+,Al(OH)3其中H+最易与OH-反应,其次为Al3+,Mg2+,反应后生成水、氢氧化铝和氢氧化镁,接着是NH4+,最后溶解Al(OH)3,故B正确;
C.0~a段加入的NaOH溶液与HCl的反应生成NaCl和水,在.a~c段的混合溶液中加入NaOH溶液,发生反应Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,至c点时Mg2+,Al3+恰好完全沉淀,溶液中还有未反应的NH4Cl,故溶液中的溶质只有NaCl,NH4Cl,故C错误;
D.d~e段加入的NaOH溶液发生的反应为Al(OH)3+OH-=AlO-2+H2O,故D错误;
故选B.
点评 理清反应的整个过程,问题即可解决,可以利用方程式进行分析,本题题目难度中等.

| 选项 | A | B | C | D |
| 实验样品 | Na2CO3 | 氯水 | NaCl固体 | 乙醇 |
| 实验数据 | 5.26mL | pH=2.3 | 10.3g | 78.3℃(沸点) |
| 实验仪器 | 酸式滴定管 | 广泛pH试纸 | 托盘天平 | 体温计 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 分离Al2O3与Fe2O3混合物可以采取加入过量NaOH溶液充分反应后,过滤、洗涤、干燥 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | 将Fe(OH)3放入表面皿中,加入足量盐酸,将反应后的溶液加热蒸干、灼烧得到Fe2O3 | |
| D. | Al(OH)3中混有Mg(OH)2加入足量烧碱溶液,充分反应过滤,向滤液中加入足量盐酸后过滤、洗涤、干燥 |
| A. | 温室效应--减少化石燃料使用,开发清洁能源 | |
| B. | 土壤污染--科学灌溉,合理使用农药和化肥 | |
| C. | 白色污染--杜绝生产塑料袋,从根源上治理 | |
| D. | 水体污染--节约用水,减少污水排放 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑫ | ⑬ |
(2)上述元素中,非金属性最强的元素符号为F,酸性最强的最高价氧化物对应的水化物的化学式为HClO4,能形成两性氢氧化物的元素的符号为Al.
(3)从⑤到⑪的元素中,原子半径最小的元素的符号为Cl.
(4)设计实验证明⑤的单质活动性比⑥的单质活动性强(简述操作过程、现象和结论)将少量Na和Mg分别投入冷水中,金属Na能与水发生剧烈反应,而金属镁反应缓慢,说明Na比Mg活泼.
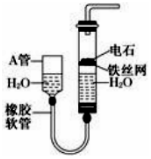 如图,图中的实验装置可用于制取乙炔.
如图,图中的实验装置可用于制取乙炔.