题目内容
20.有以下物质:A、碳酸氢钠固体 B、硝酸溶液 C、纯醋酸 D、碳酸钙 E、酒精 F、二氧化碳 G、铜
(1)下列物质中,能导电的是BG,属于非电解质的是EF,(填序号)
(2)写出A在水中的电离方程式NaHCO3=Na++HCO3-.
(3)已知浓度为0.5mol•L-1的B溶液VmL,取出10mL,则这10mL溶液中c(H+)=0.5mol/L.
(4)硝酸中N元素的化合价+5.
分析 (1)能导电的物质--必须具有能自由移动的带电的微粒,金属能导电--是由于金属中存在能自由移动的带负电的电子;
非电解质是指:在熔融状态和水溶液中都不能导电的化合物;单质,混合物既不是电解质也不是非电解质;
(2)碳酸氢钠固体为强电解质;
(3)溶液具有均一性,浓度与体积无关;
(4)根据硝酸中化合价代数和为0计算N元素的化合价.
解答 解:(1)B、硝酸溶液具有能自由移动的带电的微粒,G、铜存在能自由移动的带负电的电子,则能导电的是BG;E、酒精 F、二氧化碳都是化合物,在水溶液和熔融状态下本身都不电离而导电,属于非电解质;
故答案为:BG;EF;
(2)碳酸氢钠固体为强电解质完全电离,电离方程式为:NaHCO3=Na++HCO3-,故答案为:NaHCO3=Na++HCO3-;
(3)溶液具有均一性,与体积无关,所以取10ml后溶液的c(H+)仍然是0.5mol/L;
故答案为:0.5;
(4)硝酸中化合价代数和为0,则N元素的化合价为+5,故答案为:+5.
点评 本题考查了电解质的判断及电离方程式书写等,题目难度不大,明确电解质的概念、电离方程式的书写方法是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 22.4L氘(D2)气体,含有中子数为2NA | |
| B. | 1.6gNH2-离子所含电子数为NA | |
| C. | 4g氦气所含分子数为0.5NA | |
| D. | NA个SO3分子在标准状况下的体积为22.4L |
11.下列实验操作与预期目的或所得结论一致的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向某盐溶液中加入AgNO3溶液,产生白色沉淀;加入浓NaOH溶液加热,生成使湿润红色石蕊试纸变蓝的气体 | 该盐一定是NH4Cl |
| B | 向浓硝酸中加入足量铜片充分反应,所得气体显红棕色 | 该气体是纯净的NO2 |
| C | 常温下,向浓度均为0.01mol/L的Na2CO3和Na2SO4的混合溶液中滴加1~2滴BaCl2溶液,滤出的沉淀不溶于盐酸 | 说明常温下Ksp(BaCO3)>Ksp(BaSO4) |
| D | 向Na2O2与水反应后所得溶液中加少量MnO2 | 检验Na2O2与水反应的中 间产物为H2O2 |
| A. | A | B. | B | C. | C | D. | D |
15.①白铁(铁上镀锌)②马口铁(铁上镀锡)③铜质奖章(铁上镀铜),当镀层破坏后,铁腐蚀速率由快到慢的顺序是( )
| A. | ③①② | B. | ②①③ | C. | ③②① | D. | ①②③ |
5.下列氧化还原反应中,水作为氧化剂的是( )
| A. | 2F2+2H2O═4HF+O2 | B. | Cl2+H2O═HClO+HCl | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$CO2+H2 |
9.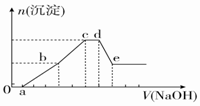 向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1mol•L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.下列有关说法正确的是( )
向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1mol•L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.下列有关说法正确的是( )
 向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1mol•L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.下列有关说法正确的是( )
向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1mol•L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.下列有关说法正确的是( )| A. | 在0~a段加入的NaOH溶液与NH4Cl反应 | |
| B. | 在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3 | |
| C. | c点溶液中溶质只有NaCl | |
| D. | 在d~e段加入NaOH溶液发生反应的离子方程式为Al3++4OH-═AlO2-+2H2O |
 将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示:
将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示: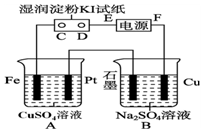 用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.
用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.