题目内容
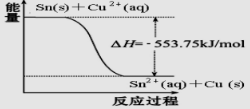
锡常用于金属的防腐镀层.25℃时,在含有Pb2+、Cu2+的某溶液 中,加入过量金属锡(Sn),发生反应:
Sn(s)+Cu 2+(aq)?Sn2+(aq)+Cu (s)
根据如图表示的反应的能量变化回答下列问题:
①1mol Cu (s)全部氧化成Cu 2+(aq)的热化学方程式为 .
②采用电解原理,在铜的表面镀上一层锡,则铜应做 极.
Sn(s)+Cu 2+(aq)?Sn2+(aq)+Cu (s)
根据如图表示的反应的能量变化回答下列问题:

①1mol Cu (s)全部氧化成Cu 2+(aq)的热化学方程式为
②采用电解原理,在铜的表面镀上一层锡,则铜应做
考点:金属的电化学腐蚀与防护,热化学方程式
专题:
分析:①根据图知,该反应Sn(s)+Cu 2+(aq)?Sn2+(aq)+Cu (s)是放热反应,其△H=-553.75 kJ?mol-1,根据能量守恒定律知,其逆反应是吸热反应,计量数不变,其焓变大小不变,据此书写其热化学反应方程式;
②电镀时,镀层作阳极、镀件作阴极,据此分析解答.
②电镀时,镀层作阳极、镀件作阴极,据此分析解答.
解答:
解:①根据图知,该反应Sn(s)+Cu 2+(aq)?Sn2+(aq)+Cu (s)是放热反应,其△H=-553.75 kJ?mol-1,根据能量守恒定律知,其逆反应是吸热反应,计量数不变,其焓变大小不变,如果有1molCu被氧化,则需要吸收553.75 kJ热量,其热化学反应方程式为Sn2+(aq)+Cu (s)=Sn(s)+Cu2+(aq)△H=+553.75 kJ?mol-1,故答案为:Sn2+(aq)+Cu (s)=Sn(s)+Cu2+(aq)△H=+553.75 kJ?mol-1;
②电镀时,镀层作阳极、镀件作阴极,所以要在铜表面上镀一层Sn,需要Cu作阴极、Sn作阳极,故答案为:阴.
②电镀时,镀层作阳极、镀件作阴极,所以要在铜表面上镀一层Sn,需要Cu作阴极、Sn作阳极,故答案为:阴.
点评:本题考查电镀、热化学方程式的书写,明确电解原理、热化学反应方程式书写方法即可解答,注意:热化学方程式中同一物质计量数不同,其焓变不同,题目难度不大.

练习册系列答案
相关题目
下列陈述ⅠⅡ正确并且有因果关系的是( )


| A、A | B、B | C、C | D、D |
 实验室里常用“碘锤”的玻璃仪器做碘的升华实验,该仪器为两头密封的玻璃窗,中间带有一根玻璃短柄.用此仪器进行有关实验时,具有装置简单、操作方便、现象明显、可反复使用等优点.用此仪器不能反复进行的实验是( )
实验室里常用“碘锤”的玻璃仪器做碘的升华实验,该仪器为两头密封的玻璃窗,中间带有一根玻璃短柄.用此仪器进行有关实验时,具有装置简单、操作方便、现象明显、可反复使用等优点.用此仪器不能反复进行的实验是( )| A、NH4Cl受热分解的实验 |
| B、无水CuSO4与胆矾的互变实验 |
| C、白磷和红磷(已经抽出O2)在一定温度下相互转变的实验 |
| D、KMnO4受热分解的实验 |
下列关于物质的检验说法正确的是( )
| A、加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子 |
| B、钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,进行灼烧,直接观察火焰颜色 |
| C、加入NaOH溶液,加热,放出能使湿润的红色石蕊试纸变蓝的气体,证明一定含有NH4+ |
| D、加入AgNO3溶液,有白色沉淀生成,证明含有Cl- |
向硝酸钠溶液中加入铜粉不发生反应,若再加入(或通入)某种物质,则铜粉可以逐渐溶解,不符合此条件的物质是( )
| A、Fe(NO3)3 |
| B、HCl |
| C、NaHSO4 |
| D、NaHCO3 |
如图所示与对应的叙述相符的是( )


| A、甲图表示可逆反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2 (g)增大压强后,V正、V逆变化图 |
| B、乙图是标准状况下,某同学向100mL H2S饱和溶液中通入SO2,所得溶液pH变化图.由图可知ab段反应是:SO2+2H2S═3S↓+2H2O |
| C、丙图表明合成氨反应温度与转化率之间的关系,由图知合成氨反应是吸热反应 |
| D、丁图表明向一定量的NaOH溶液中逐滴加入AlCl3溶液的反应.说明反应分两步:①Al3++3OH-=Al(OH)3↓②Al(OH)3+OH-=AlO2-+2H2O |
 某同学在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,由于腐蚀,其标签已破损(如图:标签上部的化学式和下部的名称都不完整),根据前几天做过的实验判断,它是中学化学中常见的溶液.
某同学在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,由于腐蚀,其标签已破损(如图:标签上部的化学式和下部的名称都不完整),根据前几天做过的实验判断,它是中学化学中常见的溶液.