题目内容
向硝酸钠溶液中加入铜粉不发生反应,若再加入(或通入)某种物质,则铜粉可以逐渐溶解,不符合此条件的物质是( )
| A、Fe(NO3)3 |
| B、HCl |
| C、NaHSO4 |
| D、NaHCO3 |
考点:铜金属及其重要化合物的主要性质
专题:几种重要的金属及其化合物
分析:A、依据铜可以与Fe3+发生氧化还原反应分析;
B、依据加入盐酸,即加入H+,H+与硝酸钠中的NO 3-构成硝酸,能氧化铜分析;
C、依据硫酸氢钠电离出H+,与B原理相同分析;
D、依据碳酸氢钠为弱酸的盐,不能电离出H+分析.
B、依据加入盐酸,即加入H+,H+与硝酸钠中的NO 3-构成硝酸,能氧化铜分析;
C、依据硫酸氢钠电离出H+,与B原理相同分析;
D、依据碳酸氢钠为弱酸的盐,不能电离出H+分析.
解答:
解:A、铜可以与Fe3+发生氧化还原反应生成亚铁离子和铜离子,故符合,故A不选择;
B、硝酸钠中加入盐酸,即加入H+,H+与NO 3-构成硝酸,能氧化铜,使铜溶解,故符合,B不选择;
C、NaHSO4=Na++H++SO 42-,H+与硝酸钠中的NO 3-构成硝酸,能氧化铜,使铜溶解,故符合,C不选择;
D、碳酸氢钠为弱酸盐,不能电离出氢离子,故不符合条件,D选择;故答案为D.
B、硝酸钠中加入盐酸,即加入H+,H+与NO 3-构成硝酸,能氧化铜,使铜溶解,故符合,B不选择;
C、NaHSO4=Na++H++SO 42-,H+与硝酸钠中的NO 3-构成硝酸,能氧化铜,使铜溶解,故符合,C不选择;
D、碳酸氢钠为弱酸盐,不能电离出氢离子,故不符合条件,D选择;故答案为D.
点评:本题主要考查的是铜的化学性质,属于常考题,需要同学们平时多总结.

练习册系列答案
相关题目
为确定下列久置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的是( )
| A、Na2SO3溶液(BaCl2) |
| B、FeCl2溶液(KSCN) |
| C、KI(淀粉溶液) |
| D、NaOH溶液(盐酸) |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
| A、生成40.0LN2(标准状况) |
| B、有0.250molKNO3被氧化 |
| C、转移电子的物质的量为2.5mol |
| D、被氧化的N原子的物质的量为3.75mol |

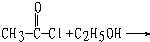
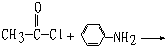
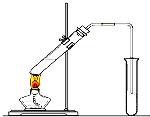 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: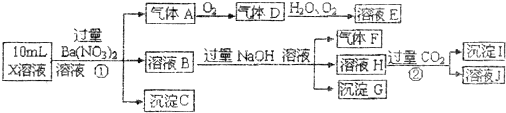
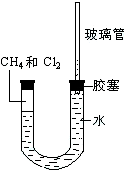 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.