题目内容
9.下列实验操作、现象和结论均正确的是( )| 选项 | 实验操作 | 现象 | 结论 |
| A | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| B | 将SO2和CO2气体分别通入水中至饱和,立即用pH计测两溶液的pH | 前者的pH小于后者 | H2SO3酸性强于H2CO3 |
| C | 铝热剂溶于足量稀盐酸再滴加KSCN溶液 | 未出现血红色 | 铝热剂中不能确定是否含有铁的氧化物 |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入几滴新制Cu(OH)2悬浊液,加热 | 没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.K元素焰色反应必须透过蓝色钴玻璃观察;
B.二者的浓度不同,不能根据溶液的pH判断溶液酸性强弱;
C.Fe与盐酸反应生成亚铁离子,遇KSCN溶液不变色;
D.做醛和氢氧化铜悬浊液的氧化反应实验时必须在碱性条件下进行.
解答 解:A.K元素焰色反应必须透过蓝色钴玻璃观察,滤去黄光的干扰,否则观察不到K元素颜色,故A错误;
B.因为二者溶解度不同,所以导致二者饱和溶液的浓度不同,不能根据溶液的pH判断溶液酸性强弱,故B错误;
C.因Fe与盐酸反应生成亚铁离子,遇KSCN溶液不变色,则铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中可含铁的氧化物,故C正确;
D.做醛和氢氧化铜悬浊液的氧化反应实验时必须在碱性条件下进行,所以在加入新制氢氧化铜悬浊液之前必须加入NaOH中和未反应的稀硫酸,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及醛基检验、离子检验、酸性强弱判断、焰色反应等知识点,明确实验原理及物质性质是解本题关键,注意从实验操作规范性、物质性质来分析评价,易错选项是B.

练习册系列答案
相关题目
15.铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称.由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚.某研究性学习小组为了证明铁的金属活动性比铜强,他们设计了如下方案,设计合理的是( )
| A. | 铁片置于硫酸铜溶液中有铜析出 | |
| B. | 铁、铜和氯气反应分别生成FeCl3和CuCl2 | |
| C. | 足量的铁粉和铜粉与浓硫酸反应生成FeSO4和CuSO4 | |
| D. | 铜片置于FeCl3溶液中铜片逐渐溶解 |
20.下列有关电池的说法中正确的是( )
| A. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| B. | 铜锌原电池工作时,电子从铜电极沿外电路流向锌电极 | |
| C. | 铅蓄电池的负极为PbO2,属于二次电池 | |
| D. | 锌锰干电池中,锌电极是负极 |
17.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
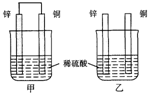

| A. | 两烧杯中铜片表面均无气泡产生 | |
| B. | 甲中铜片是正极,乙中铜片是负极 | |
| C. | 两烧杯中溶液的酸性均减弱 | |
| D. | 甲装置的导线中有电流,电流方向为锌→铜 |
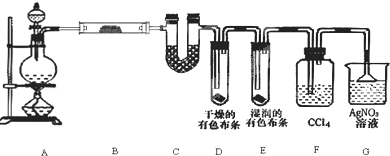
4.某化学兴趣小组利用MnO2 和浓HCl 及如图装置制备Cl2.下列分析中不正确的是( )

| A. | A 中可用分液漏斗代替长颈漏斗 | |
| B. | A 中缺少加热装置 | |
| C. | B 中盛放的NaOH 溶液可以净化Cl2 | |
| D. | D 中盛放的NaOH 溶液可以吸收尾气 |
19.下列措施符合安全要求的是( )
| A. | 金属钠着火时,立即用沾水的毛巾覆盖 | |
| B. | 将含有硫酸的废液倒人水池,用大量水冲人下水道 | |
| C. | 锌和稀硫酸反应生成的氢气可直接点燃,观察火焰的颜色 | |
| D. | 大量氯气泄漏时,迅速离开现场并尽量往高处去 |