题目内容
14.向某溶液中投入铝片后有大量H2放出,则溶液中不可能大量存在的离子是( )| A. | Cl- | B. | Na+ | C. | NO3- | D. | HCO-3 |
分析 投入铝片后有大量H2放出的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子能够与氢离子、氢氧根离子反应,在溶液中不能大量共存.
解答 解:向某溶液中投入铝片后有大量H2放出,该溶液呈酸性或强碱性,溶液中存在大量氢离子或氢氧根离子,
A.Cl-不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故A错误;
B.Na+不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故B错误;
C.NO3-不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故C错误;
D.HCO3-与氢离子、氢氧根离子反应,在溶液中不能大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
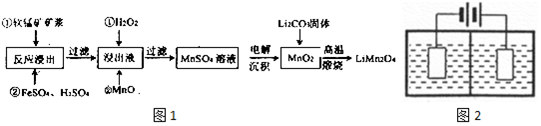
3.新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2.工业上用某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂的流程如图1:
有关物质的溶度积常数
(1)已知,锂电池放电正极的电极反应为:LiMn2O4+e-+Li+═Li2Mn2O4,则锂电池正极材料锰酸锂中,锰元素的化合价为+3、+4.
(2)流程中,FeSO4的作用是作还原剂,还原MnO2,MnO的作用是调节滤液的pH,除去Fe3+和Al3+,当滤液中的pH为6时,滤液中所含铝离子的浓度为4.5×10-9mol•L-1.
(3)采用图2装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为硫酸钠溶液;电解产生的MnO2沉积在电极上,该电极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出.则Fe2+与矿浆中MnO2反应的离子方程式为2Fe2++MnO2+44H+=2Fe3++Mn2++2H2O.
(5)写出高温煅烧生成锰酸锂的化学方程式8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.

有关物质的溶度积常数
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
(2)流程中,FeSO4的作用是作还原剂,还原MnO2,MnO的作用是调节滤液的pH,除去Fe3+和Al3+,当滤液中的pH为6时,滤液中所含铝离子的浓度为4.5×10-9mol•L-1.
(3)采用图2装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为硫酸钠溶液;电解产生的MnO2沉积在电极上,该电极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出.则Fe2+与矿浆中MnO2反应的离子方程式为2Fe2++MnO2+44H+=2Fe3++Mn2++2H2O.
(5)写出高温煅烧生成锰酸锂的化学方程式8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.
2.实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )
| A. | 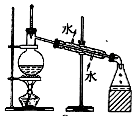 装置常用于分离互不相溶的液体混合物 | |
| B. | 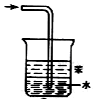 装置可用于吸收氨气,且能防止倒吸 | |
| C. | 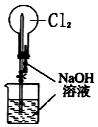 用装置不可以完成“喷泉”实验 | |
| D. | 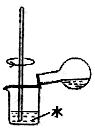 用装置稀释浓硫酸和铜反应冷却后的混合液 |
9.下列关于钠的说法中不正确的是( )
| A. | 金属钠和氧气反应,条件不同,产物则不同 | |
| B. | 钠长期放置在空气中,最终将变成碳酸钠 | |
| C. | 钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中 | |
| D. | 将一小块钠投入氯化铁溶液时,既能产生气体又会出现白色沉淀 |
19.下列化学反应的离子方程式正确的是( )
| A. | 将少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 将铝片加入烧碱溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+═SO2↑+H2O | |
| D. | 向澄清石灰水中通入过量的二氧化碳:Ca2++2OH-═CaCO3↓+H2O |
6.在日光的照射下,下列物质不发生化学变化的是( )
| A. | 浓HNO3 | B. | H2和N2的混合气 | C. | 溴化银 | D. | 氯水 |
3.在反应3Cl2+2FeBr2═2FeCl3+2Br2中被还原的元素是( )
| A. | Fe | B. | Fe和Cl | C. | Cl | D. | Br |
4.下列有关说法不正确的是( )
| A. | 任何烷烃分子中碳氢原子个数比都是相同的 | |
| B. | 烷烃的沸点随碳原子数增加而逐渐升高 | |
| C. | 丙烷与Cl2发生取代反应后生成的一氯代物不只是一种 | |
| D. | 正丁烷的熔点、沸点比异丁烷的高 |