题目内容
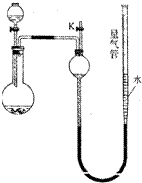 某同学设计如图所示装置(夹持装置已略去,量气管可上下移动)可分别进行下列实验探究
某同学设计如图所示装置(夹持装置已略去,量气管可上下移动)可分别进行下列实验探究| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | 铜片、浓HNO3(过量) | NO2 | CCl4 |
| Ⅱ | NH3 | 煤油 | |
| Ⅲ | MnO2,HCl(浓) | Cl2 | |
| Ⅳ | 硅铁合金、NaOH溶液 | H2 | H2O |
(1)实验前,某同学检查装置气密性的操作方法是:将活塞K关闭,再将量气管向上提高,其判断装置漏气或不漏气的现象分别是
(2)另一同学欲通过实验1收集并测量NO2气体的体积来探究铜片的纯度,所测得的结果比真实值偏小(不考虑操作误差),你认为可能的原因是
(3)若进行实验Ⅱ制NH3,则烧瓶和分液漏斗中应分别盛装适量的
(4)若进行实验Ⅲ,该装置缺少的必须仪器是
量气管中最好装的液体是
a.NaOH溶液 b水 C.饱和NaCl溶液 d.苯乙烯
(5)实验Ⅳ时,应对量气管多次读数,读数时应注意:
①将实验装置恢复到室温,
②
③读数时,视线与凹液面最低处水平相切.
经多次重复实验,获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 | 某硅铁合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 336.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
考点:性质实验方案的设计
专题:实验设计题
分析:(1)设法使装置内外形成气压差,看气压差变不变化是气密性检查的常用方法;
(2)根据二氧化氮气体的性质判断,二氧化氮气能转化为四氧化二氮,据此分析;
(3)实验室制NH3;
(4)实验室用MnO2和浓HCl制取氯气原理;
(5)对量气管读数时,首先等实验装置恢复到室温再进行下一步操作,然后调节量气管使左右液面相平,最后读数时视线与凹液面最低处相平.
(2)根据二氧化氮气体的性质判断,二氧化氮气能转化为四氧化二氮,据此分析;
(3)实验室制NH3;
(4)实验室用MnO2和浓HCl制取氯气原理;
(5)对量气管读数时,首先等实验装置恢复到室温再进行下一步操作,然后调节量气管使左右液面相平,最后读数时视线与凹液面最低处相平.
解答:
解:(1)用液差法检查是否漏气,将活塞K关闭,再将量气管向上提高使形成液面差,量气管液面高于长颈漏斗内液面,且始终保持不变,则装置不漏气,反之,则装置漏气;
故答案为:量气管液面高于长颈漏斗内液面,且始终保持不变,则装置不漏气;若量气管中液面下降至与长颈漏斗内液面相平,则装置漏气;
(2)二氧化氮气体的性质:可以与水反应生成硝酸和一氧化氮,也可以转化为N2O4,存在2NO2?N2O4的化学平衡,都使得气体体积偏小;
故答案为:实验中存在2NO2?N2O4的化学平衡,使得气体体积偏小,(或部分NO2溶于浓HNO3,);
(3)氨水中存在平衡:NH3+H2O?NH3?H2O?NH4++OH-;氧化钙和水反应放热,使氨水更容易挥发成氨气,消耗了水,而且还增加了氢氧根离子,使弱电解质一水合氨的电离平衡逆向移动,从而加大水中NH3的浓度,有利于氨水挥发成氨气;
故答案为:氧化钙(或氢氧化钠或碱石灰等)和浓氨水;
(4)实验Ⅲ为:MnO2和浓HCl制取氯气,MnO2和浓HCl在加热条件下反应生成氯气,反应方程式为:MnO2+4HCl
MnCl2+Cl2↑+2H2O,离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故该装置缺少的必须仪器是酒精灯,氯气能和碱、烯烃反应,也能溶于水,所以量气管中液体不能选用NaOH溶液、苯乙烯和水,氯气在饱和NaCl溶液溶解度很小,故选用选饱和NaCl溶液溶;
故答案为:酒精灯;MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;c;
(5)为保证测出来的气体体积是当时大气压下的体积,在读数时应注意:①将实验装置恢复到室温,②使量气管两端液面相平,因为相平说明两边液面上的压强是一样的,这样测出来的气体体积才是当时大气压下的体积,③视线与凹液面最低处相平,俯视或仰视会造成误差;
硅铁合金中只有硅和氢氧化钠反应生成氢气,表中量气管第二次读数与第一次读书之差为产生氢气的体积,分析三组数值知,第②组实验误差较大,应该舍弃,故硅和氢氧化钠反应生成氢气的体积=
=336.0(mL)
=0.336L;设生成0.336L氢气,需硅的质量为x
Si+2NaOH+H2O=Na2SiO3+2H2↑,
28g 2×22.4L
x 0.336L
=
,解得x=0.21g
硅的质量分数=
×100%=21.0%
故答案为:使量气管两端液面相平;21.0%.
故答案为:量气管液面高于长颈漏斗内液面,且始终保持不变,则装置不漏气;若量气管中液面下降至与长颈漏斗内液面相平,则装置漏气;
(2)二氧化氮气体的性质:可以与水反应生成硝酸和一氧化氮,也可以转化为N2O4,存在2NO2?N2O4的化学平衡,都使得气体体积偏小;
故答案为:实验中存在2NO2?N2O4的化学平衡,使得气体体积偏小,(或部分NO2溶于浓HNO3,);
(3)氨水中存在平衡:NH3+H2O?NH3?H2O?NH4++OH-;氧化钙和水反应放热,使氨水更容易挥发成氨气,消耗了水,而且还增加了氢氧根离子,使弱电解质一水合氨的电离平衡逆向移动,从而加大水中NH3的浓度,有利于氨水挥发成氨气;
故答案为:氧化钙(或氢氧化钠或碱石灰等)和浓氨水;
(4)实验Ⅲ为:MnO2和浓HCl制取氯气,MnO2和浓HCl在加热条件下反应生成氯气,反应方程式为:MnO2+4HCl
| ||
| ||
故答案为:酒精灯;MnO2+4H++2Cl-
| ||
(5)为保证测出来的气体体积是当时大气压下的体积,在读数时应注意:①将实验装置恢复到室温,②使量气管两端液面相平,因为相平说明两边液面上的压强是一样的,这样测出来的气体体积才是当时大气压下的体积,③视线与凹液面最低处相平,俯视或仰视会造成误差;
硅铁合金中只有硅和氢氧化钠反应生成氢气,表中量气管第二次读数与第一次读书之差为产生氢气的体积,分析三组数值知,第②组实验误差较大,应该舍弃,故硅和氢氧化钠反应生成氢气的体积=
| 346.3mL-10.0mL+345.7mL-10.0mL |
| 2 |
=0.336L;设生成0.336L氢气,需硅的质量为x
Si+2NaOH+H2O=Na2SiO3+2H2↑,
28g 2×22.4L
x 0.336L
| 28g |
| x |
| 2×22.4L |
| 0.336L |
硅的质量分数=
| 0.21g |
| 1.0g |
故答案为:使量气管两端液面相平;21.0%.
点评:本题考查了测定气体体积的方法,难度不大,易错题是量气管中液体的选择,选择标准是和该气体不反应.综合性较强,计算时要注意数据的取舍.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列变化需加入还原剂才能实现的是( )
| A、Na→Na2O2 |
| B、Fe 3+→【Fe(SCN)】2+ |
| C、Cl-→Cl2 |
| D、Fe 3+→Fe 2+ |
“环境保护,以人为本”.新调整的北京空气质量指标中指出,影响北京空气质量的一组主要污染物是( )
| A、CO2、N2、O2 |
| B、SO2、NO2、可吸入颗粒物 |
| C、CO2、O2、SO2 |
| D、NO2、N2、可吸入颗粒物 |
下列离子方程式正确的是( )
| A、铁和盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、足量碳酸氢钠溶液中滴加少量的石灰水:2HCO3-+Ca2++2 OH-═CaCO3↓+CO32-+2H2O |
| C、碳酸钙溶于稀醋酸:CO32-+2H+=H2O+CO2↑ |
| D、氯化钙溶液与CO2的反应:CO2+Ca2++H2O═CaCO3↓+2H+ |
下列离子方程式书写正确的是( )
| A、碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O |
| B、稀硫酸和氨水反应:H++NH3?H2O═NH4++H2O |
| C、氢氧化钠和硫酸反应:2OH-+H2SO4═SO42-+2H2O |
| D、铁钉放入硫酸铜溶液中:Fe+3Cu2+═2Fe3++3Cu |
下列物质中,能够导电的是( )
| A、二氧化碳 | B、稀盐酸 |
| C、蔗糖 | D、NaCl固体 |