��Ŀ����
������һ�������Դ�����Ǻϳɰ���ҵ����Ҫԭ�ϣ���֪�����ж�����ȡ������
�ٻ��ý��������ơ��أ�ֱ�Ӹ�ˮ��Ӧ��
�ڽ�������п������������ϡ�����ϡ���ᷴӦ��
�۵��ˮ��������
����ú��̿��ˮ��Ӧ��ȡ������C+H2O��g��
CO+H2��
������Ȼ����������ȡ������CH4+H2O��g��
CO+3H2��
��1�������ٲ���һ����ȡ�����ķ�����д���÷�Ӧ�Ļ�ѧ����ʽ ��
��2���ȽϷ����ٺ͢ݣ� g�����Ƹ�ˮ��Ӧ���״����11.2L CH4��ˮ��Ӧ��������������ȣ�
��3���ڼס��ҡ���3���ݻ���Ϊ2L���ܱ������У�����ͬ���¶��¡�ʹ����ͬ�Ĵ����ֱ�������·�Ӧ��
3H2��g��+N2��g��
2NH3��g�����ְ���ͬ���Ͷ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ�й��������£�
�ٷ��������ݣ����й�ϵ��ȷ���� ����д�����ĸ����
A��2c1��1.5mol/L B����3=��1 C��2��1=��2
���ڸ��¶��¸÷�Ӧ��ƽ�ⳣ��K= ���ú�c1�Ĵ���ʽ��ʾ����
��4����֪��CH4��g��+H2O��g��=CO��g��+3H2��g������H=+206.2kJ?mol-1
CH4��g��+CO2��g��=2CO��g��+2H2��g������H=+247.4kJ?mol-1
������H2O��g����Ӧ����H2��CO2���Ȼ�ѧ����ʽΪ ��
��5����ͼ��ʾװ�ù���ʱ����H2�йأ�
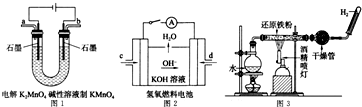
��ͼ1��ʾװ���������ĵ缫��ӦʽΪ ��
��ͼ2��ʾװ���У�ͨ��H2�Ĺܿ��� ��ѡ����ĸ���ţ���
��ijͬѧ��ͼ3��ʾװ�ý���ʵ�飬ʵ��������������ڹ���������ȴ������ϡ���ᣬ��ַ�Ӧ�μ�KSCN��Һ����Һ����죬�ٵ���������ˮ����Һ��Ϊ��ɫ����ͬѧ�ݴ˵ó����ۣ�����ˮ������Ӧ����FeO��H2���ý��� ������ܡ������ܡ�������������� �������ӷ���ʽ��ʾ����
�ٻ��ý��������ơ��أ�ֱ�Ӹ�ˮ��Ӧ��
�ڽ�������п������������ϡ�����ϡ���ᷴӦ��
�۵��ˮ��������
����ú��̿��ˮ��Ӧ��ȡ������C+H2O��g��
| ||
������Ȼ����������ȡ������CH4+H2O��g��
| ||
| ���� |
��1�������ٲ���һ����ȡ�����ķ�����д���÷�Ӧ�Ļ�ѧ����ʽ
��2���ȽϷ����ٺ͢ݣ�
��3���ڼס��ҡ���3���ݻ���Ϊ2L���ܱ������У�����ͬ���¶��¡�ʹ����ͬ�Ĵ����ֱ�������·�Ӧ��
3H2��g��+N2��g��
| ���¸�ѹ |
| ���� |
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 3 mol H2��2 mol N2 | 6 mol H2��4mol N2 | 2 mol NH3 |
| �ﵽƽ���ʱ�䣨min�� | t1 | 5 | 8 |
| N2��Ũ�ȣ�mol/L�� | c1 | 1.5 | c3 |
| NH3��������� | ��1 | ��2 | ��3 |
| ��������ܶȣ�g/L�� | ��1 | ��2 | ��3 |
A��2c1��1.5mol/L B����3=��1 C��2��1=��2
���ڸ��¶��¸÷�Ӧ��ƽ�ⳣ��K=
��4����֪��CH4��g��+H2O��g��=CO��g��+3H2��g������H=+206.2kJ?mol-1
CH4��g��+CO2��g��=2CO��g��+2H2��g������H=+247.4kJ?mol-1
������H2O��g����Ӧ����H2��CO2���Ȼ�ѧ����ʽΪ
��5����ͼ��ʾװ�ù���ʱ����H2�йأ�

��ͼ1��ʾװ���������ĵ缫��ӦʽΪ
��ͼ2��ʾװ���У�ͨ��H2�Ĺܿ���
��ijͬѧ��ͼ3��ʾװ�ý���ʵ�飬ʵ��������������ڹ���������ȴ������ϡ���ᣬ��ַ�Ӧ�μ�KSCN��Һ����Һ����죬�ٵ���������ˮ����Һ��Ϊ��ɫ����ͬѧ�ݴ˵ó����ۣ�����ˮ������Ӧ����FeO��H2���ý���
���㣺��ѧƽ��ļ���,���ԭ��
ר�⣺
��������1���������������ķ�Ӧ��д��
��2������������ͬ���������м��㣻
��3�����Ƚ����е����ݰ��ջ�ѧ������ת���ɷ�Ӧ�ﵪ�������������ʵ�����Ȼ�����õ�Чƽ��֪ʶ���з�����
�ڼ������Ӧǰ���������������ʵ���Ũ�ȣ�Ȼ�����û�ѧƽ������ʽ������ﵽƽ��ʱ����ֵ�Ũ�ȣ������ݻ�ѧƽ�ⳣ������ʽ��������¶��µ�ƽ�ⳣ����
��4�������Ȼ�ѧ����ʽ��˹���ɼ���õ������Ȼ�ѧ����ʽ��
��5����������ʧ���ӷ���������Ӧ��
�ڸ������������ӵ��ƶ����������ķ�Ӧ�ж��������ڵĵ缫��
�۸��ݷ�Ӧ����֪����Һ��û�������ӣ�ԭ���Dz�����δ������������ʣ������������ӷ�Ӧ�����������ӣ�
��2������������ͬ���������м��㣻
��3�����Ƚ����е����ݰ��ջ�ѧ������ת���ɷ�Ӧ�ﵪ�������������ʵ�����Ȼ�����õ�Чƽ��֪ʶ���з�����
�ڼ������Ӧǰ���������������ʵ���Ũ�ȣ�Ȼ�����û�ѧƽ������ʽ������ﵽƽ��ʱ����ֵ�Ũ�ȣ������ݻ�ѧƽ�ⳣ������ʽ��������¶��µ�ƽ�ⳣ����
��4�������Ȼ�ѧ����ʽ��˹���ɼ���õ������Ȼ�ѧ����ʽ��
��5����������ʧ���ӷ���������Ӧ��
�ڸ������������ӵ��ƶ����������ķ�Ӧ�ж��������ڵĵ缫��
�۸��ݷ�Ӧ����֪����Һ��û�������ӣ�ԭ���Dz�����δ������������ʣ������������ӷ�Ӧ�����������ӣ�
���
�⣺��1������������������ķ�Ӧ������������������������������������Ӧ����ʽΪ2Al+2 NaOH+2 H2O=2 NaAlO2+3 H2����
�ʴ�Ϊ��2Al+2 NaOH+2 H2O=2 NaAlO2+3 H2����
��2���ɷ�Ӧ�ݱ�״����11.2L CH4��ˮ��Ӧ�������������ʵ���Ϊ
��3=1.5mol
�ָ���2Na+2 H2O=2 NaOH+H2����Ҫ����1.5mol��������Ҫ��3mol������Ҫ�Ƶ�����Ϊ3mol��23g/mol=69g��
�ʴ�Ϊ��69��
��3���ٺ��¡����������£�
A���������������ݻ�Ϊ4L����ﵽƽ��ʱ����Ϊ��Чƽ�⣬����ֵĺ�����Ũ����ȣ���ʱ������Ũ��Ϊc1��Ȼ���������ݻ���С��2L����ƽ�ⲻ�ƶ���2c1=1.5mol/L������ѹǿ����ƽ�����������ƶ���������Ũ����������2c1��1.5mol/L����A��ȷ��
B������2mol�����൱�ڼ�����1mol������3mol������������Ϊ3mol H2��2mol N2�����ڱ���Ӧ�ﵪ�������ʵ�����С�����ɵİ��������ʵ�����С�����Ԧ�3����1����B����
C����Ӧǰ�������壬�������ݻ�����2L�����л�����������Ϊ��2�������ݦ�=
��֪��2��1=��2����C��ȷ��
��ѡAC��
�ڼ������У���Ӧǰ����Ũ��Ϊ��c��H2��=
=1.5mol/L��������Ũ��Ϊ��
=1mol/L���ﵽƽ��ʱ������Ũ�ȱ仯Ϊ����1-c1��mol/L��
�ɻ�ѧƽ�������ʽ�ɵã�3H2��g��+N2��g��?2NH3��g��
��Ӧǰ��mol/L����1.5 1 0
Ũ�ȱ仯����mol/L����3��1-c1�� ��1-c1�� 2��1-c1��
��Ӧ��mol/L����1.5-3��1-c1�� 1-��1-c1�� 2��1-c1��
�ڸ��¶��¼������з�Ӧ��ƽ�ⳣ��K=
��
�ʴ�Ϊ��
��
��4����CH4��g��+H2O��g���TCO��g��+3H2��g����H=+206.2kJ?mol-1
��CH4��g��+CO2��g���T2CO��g��+2H2��g����H=+247.4kJ?mol-1
�١�2-�ڵõ�CH4��g��+2H2O��g���TCO2��g��+4H2��g����H=+165kJ?mol-1 ��
�ʴ�Ϊ��CH4��g��+2H2O��g���TCO2��g��+4H2��g����H=+165kJ?mol-1��
��5�������������������ʧ�������ɸ���������ӣ��缫��ӦʽΪ��MnO42--e-=MnO4-���ʴ�Ϊ��MnO42--e-=MnO4-��
������ȼ�ϼ��Ե���У�����ʧ���Ӻ����������ӷ�Ӧ����ˮ��ͼƬ��������������d�缫�ƶ���˵��d�缫�����������ʴ�Ϊ��d��
������ˮ�����ڸ����·�Ӧ�������������������������ݷ�Ӧ����֪���÷�Ӧ�в�����δ�μӷ�Ӧ����ʣ������������ӷ�Ӧ���ɶ��������ӣ����ӷ���ʽΪ��2Fe3++Fe=3Fe2+������˵�����ܣ��ʴ�Ϊ�������ܣ� 2Fe3++Fe=3Fe2+��
�ʴ�Ϊ��2Al+2 NaOH+2 H2O=2 NaAlO2+3 H2����
��2���ɷ�Ӧ�ݱ�״����11.2L CH4��ˮ��Ӧ�������������ʵ���Ϊ
| 11.2L |
| 22.4L/mol |
�ָ���2Na+2 H2O=2 NaOH+H2����Ҫ����1.5mol��������Ҫ��3mol������Ҫ�Ƶ�����Ϊ3mol��23g/mol=69g��
�ʴ�Ϊ��69��
��3���ٺ��¡����������£�
A���������������ݻ�Ϊ4L����ﵽƽ��ʱ����Ϊ��Чƽ�⣬����ֵĺ�����Ũ����ȣ���ʱ������Ũ��Ϊc1��Ȼ���������ݻ���С��2L����ƽ�ⲻ�ƶ���2c1=1.5mol/L������ѹǿ����ƽ�����������ƶ���������Ũ����������2c1��1.5mol/L����A��ȷ��
B������2mol�����൱�ڼ�����1mol������3mol������������Ϊ3mol H2��2mol N2�����ڱ���Ӧ�ﵪ�������ʵ�����С�����ɵİ��������ʵ�����С�����Ԧ�3����1����B����
C����Ӧǰ�������壬�������ݻ�����2L�����л�����������Ϊ��2�������ݦ�=
| m |
| V |
��ѡAC��
�ڼ������У���Ӧǰ����Ũ��Ϊ��c��H2��=
| 3mol |
| 2L |
| 2mol |
| 2L |
�ɻ�ѧƽ�������ʽ�ɵã�3H2��g��+N2��g��?2NH3��g��
��Ӧǰ��mol/L����1.5 1 0
Ũ�ȱ仯����mol/L����3��1-c1�� ��1-c1�� 2��1-c1��
��Ӧ��mol/L����1.5-3��1-c1�� 1-��1-c1�� 2��1-c1��
�ڸ��¶��¼������з�Ӧ��ƽ�ⳣ��K=
| (2-2c 1)2 |
| c1?(3c 1-1.5) 3 |
�ʴ�Ϊ��
| (2-2c 1)2 |
| c1?(3c 1-1.5) 3 |
��4����CH4��g��+H2O��g���TCO��g��+3H2��g����H=+206.2kJ?mol-1
��CH4��g��+CO2��g���T2CO��g��+2H2��g����H=+247.4kJ?mol-1
�١�2-�ڵõ�CH4��g��+2H2O��g���TCO2��g��+4H2��g����H=+165kJ?mol-1 ��
�ʴ�Ϊ��CH4��g��+2H2O��g���TCO2��g��+4H2��g����H=+165kJ?mol-1��
��5�������������������ʧ�������ɸ���������ӣ��缫��ӦʽΪ��MnO42--e-=MnO4-���ʴ�Ϊ��MnO42--e-=MnO4-��
������ȼ�ϼ��Ե���У�����ʧ���Ӻ����������ӷ�Ӧ����ˮ��ͼƬ��������������d�缫�ƶ���˵��d�缫�����������ʴ�Ϊ��d��
������ˮ�����ڸ����·�Ӧ�������������������������ݷ�Ӧ����֪���÷�Ӧ�в�����δ�μӷ�Ӧ����ʣ������������ӷ�Ӧ���ɶ��������ӣ����ӷ���ʽΪ��2Fe3++Fe=3Fe2+������˵�����ܣ��ʴ�Ϊ�������ܣ� 2Fe3++Fe=3Fe2+��
���������⿼���˻�ѧƽ���Ӱ�����ط�������ѧ��Ӧ���ʵ�Ӱ�������жϡ���ѧ��Ӧ���ʵļ��㡢�绯ѧ֪ʶ��֪ʶ����Ŀ�Ѷ��еȣ�ע�����ջ�ѧƽ���Ӱ�����ء���ѧ��Ӧ���ʵļ��㷽�����ܹ����ø�˹�������㷴Ӧ�е��ʱ䣬�״���������ȼ�ϵ���е缫���жϣ���ȷ��Һ�����ӵ��ƶ������ǽ����Ĺؼ���

��ϰ��ϵ�д�
�����Ŀ
��֪101kPa���У�H2��g��+
O2��g��=H2O��g������H=-241.8kJ/mol��������˵�����������ȷ���ǣ�������
| 1 |
| 2 |
| A��H2��ȼ����Ϊ241.8kJ/mol | ||
B��H2��g��+
| ||
| C��2H2��g��+O2��g��=2H2O��g������H��-241.8kJ/mol | ||
D��1molH2��
|
���Ϊ�йػ������pKsp��pKsp=-lgKsp��ijͬѧ���ʵ�����£�����AgNO3��Һ�м�������NaX��Һ���õ�����AgX��������м�NaY�������ת��ΪAgY��������м���NaZ��������ת��ΪAgZ�������a��b��c�Ĵ�С��ϵΪ��������
| ��ػ����� | AgX | AgY | AgZ |
| pKsp | a | b | c |
| A��a��b��c |
| B��a��b��c |
| C��c��a��b |
| D��a+b=c |
ʵ���ҷ�����ᴿ�������ʵķ����У�������ǣ�������
| A������ˮ����ȡ�嵥��--��ȡ�� |
| B���Ӻ������Ȼ��Ƶ�����ع������ᴿ�����--�ᾧ�� |
| C������CCl4��H2O--���˷� |
| D���������ᣨ�е�118�棩�������������е�77.1�棬����������ܣ��Ļ��Һ--���� |
 ����ǰ����������Ԫ��X��Y��Z��E��F��G�����ǵ�ԭ��������������G�⣬��������Ԫ�ض��Ƕ�����Ԫ�أ�X��Y��E����Ԫ����ɵĻ�������ʵ���ҳ���ȼ�ϣ�Ҳ��һ�ּ�ͥ������Ʒ����Ҫ�ɷ֣�ȡF�Ļ���������ɫ��Ӧʵ�飬����ɫ�ʻ�ɫ��G�ĵ����������г�����һ�ֽ�����GE�Ǻ�ɫ���壮G2E�Ǻ�ɫ���壮��ش��������⣺
����ǰ����������Ԫ��X��Y��Z��E��F��G�����ǵ�ԭ��������������G�⣬��������Ԫ�ض��Ƕ�����Ԫ�أ�X��Y��E����Ԫ����ɵĻ�������ʵ���ҳ���ȼ�ϣ�Ҳ��һ�ּ�ͥ������Ʒ����Ҫ�ɷ֣�ȡF�Ļ���������ɫ��Ӧʵ�飬����ɫ�ʻ�ɫ��G�ĵ����������г�����һ�ֽ�����GE�Ǻ�ɫ���壮G2E�Ǻ�ɫ���壮��ش��������⣺