题目内容
(1)已知在常温常压下:
①CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H1=-442.8KJ/mol
②2CO(g)+O2(g)=2CO2(g);△H2=-566.0kJ/mol
写出表示甲醇燃烧热的热化学方程式
(2)已知合成氨的热化学方程式为:N2(g)+3H2(g)?2NH3(g);△H=-92.2KJ?mol-1
如表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
根据表中数据计算:
①反应进行到2小时时放出的热量为 KJ.
②0~1小时内N2的平均反应速率 mol?L-1?h-1.
③此条件下该反应的化学平衡常数K= (保留两位小数).
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”)
①CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H1=-442.8KJ/mol
②2CO(g)+O2(g)=2CO2(g);△H2=-566.0kJ/mol
写出表示甲醇燃烧热的热化学方程式
(2)已知合成氨的热化学方程式为:N2(g)+3H2(g)?2NH3(g);△H=-92.2KJ?mol-1
如表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为
②0~1小时内N2的平均反应速率
③此条件下该反应的化学平衡常数K=
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡向
考点:用盖斯定律进行有关反应热的计算,化学平衡建立的过程
专题:基本概念与基本理论
分析:(1)根据盖斯定律,利用已知热化学方程式乘以适当的系数进行加减构造出目标热化学方程式,反应热也乘以相应的系数进行相应的加减.
(2)①依据反应的焓变结合化学方程式计算放出的热量;
②根据氨气的物质的量计算出消耗的氮气的物质的量,再根据v=
计算出0~1小时内N2的平均反应速度率;
③根据3、4小时的时间段氨气的物质的量不变,说明达到了平衡状态,根据氨气的物质的量计算出消耗的氮气和氢气的物质的量及平衡时的浓度,
再根据平衡常数表达式K=
计算出该温度下的平衡常数;
④根据加入氨气、水和氨气后的浓度商判断平衡移动方向.
(2)①依据反应的焓变结合化学方程式计算放出的热量;
②根据氨气的物质的量计算出消耗的氮气的物质的量,再根据v=
| △c |
| △t |
③根据3、4小时的时间段氨气的物质的量不变,说明达到了平衡状态,根据氨气的物质的量计算出消耗的氮气和氢气的物质的量及平衡时的浓度,
再根据平衡常数表达式K=
| c2(NH3) |
| c(N2)?c3(H2) |
④根据加入氨气、水和氨气后的浓度商判断平衡移动方向.
解答:
解:(1)已知①CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H1=-442.8KJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
由盖斯定律,①+②×
得:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l);△H=(-442.8KJ/mol)-(-566.0kJ/mol)×
=-725.8KJ/mol,
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.8KJ/mol;
(2)①N2(g)+3H2(g)?2NH3(g)△H=-92.20kJ?mol-1,生成2mol氨气放热92.30kJ,反应进行到2小时时,氮气的物质的量变化了1.5mol-1.2mol=0.3mol,则生成氨气0.6mol,放出的热量为
×0.6kJ=27.66kJ,
故答案为:27.66;
②0~1小时内生成了0.2mol氨气,根据反应N2(g)+3H2(g)?2NH3(g),消耗了氮气的物质的量为:n(N2)=
n(NH3)=0.1mol,0~1小时内N2的平均反应速度率为:v(N2)=
=0.05mol/(L?h),
故答案为:0.05;
③根据表中数据可知,反应在第3和4小时时间段内氨气的物质的量不变,说明达到了平衡状态,此时生成了1.00mol氨气,
列出化学平衡的三段式为 N2(g)+3H2(g)?2NH3(g),
反应开始前(mol) 1.5 4.5 0
变化量(mol) 0.5 1.5 1
平衡时(mol) 1 3 1
平衡时浓度(mol/L) 0.500 1.500 0.5
此温度下该反应的化学平衡常数K=
=
≈0.15,
故答案为:0.15;
④反应达到平衡后,若往平衡体系中再加入N2、H2O、NH3各1mol,此时各组分的浓度为:
c(N2)=
=1.00mol/L,c(H2)=
=2.00mol/L,c(N2)=
=1.00mol/L,
浓度商为:
=
=0.125<k=0.15,所以平衡向着正向移动,
故答案为:正反应.
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
由盖斯定律,①+②×
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(2)①N2(g)+3H2(g)?2NH3(g)△H=-92.20kJ?mol-1,生成2mol氨气放热92.30kJ,反应进行到2小时时,氮气的物质的量变化了1.5mol-1.2mol=0.3mol,则生成氨气0.6mol,放出的热量为
| 92.20 |
| 2 |
故答案为:27.66;
②0~1小时内生成了0.2mol氨气,根据反应N2(g)+3H2(g)?2NH3(g),消耗了氮气的物质的量为:n(N2)=
| 1 |
| 2 |
| ||
| 1h |
故答案为:0.05;
③根据表中数据可知,反应在第3和4小时时间段内氨气的物质的量不变,说明达到了平衡状态,此时生成了1.00mol氨气,
列出化学平衡的三段式为 N2(g)+3H2(g)?2NH3(g),
反应开始前(mol) 1.5 4.5 0
变化量(mol) 0.5 1.5 1
平衡时(mol) 1 3 1
平衡时浓度(mol/L) 0.500 1.500 0.5
此温度下该反应的化学平衡常数K=
| c2(NH3) |
| c(N2)?c3(H2) |
| 0.5002 |
| 1.5003×0.500 |
故答案为:0.15;
④反应达到平衡后,若往平衡体系中再加入N2、H2O、NH3各1mol,此时各组分的浓度为:
c(N2)=
| 1.00mol+1.00mol |
| 2.00L |
| 3.00mol+1.00mol |
| 2.00L |
| 1.00mol+1.00mol |
| 2.00L |
浓度商为:
| c2(NH3) |
| c(N2)?c3(H2) |
| 1.002 |
| 2.003×1.00 |
故答案为:正反应.
点评:本题考查了盖斯定律的应用、反应热的计算、化学平衡常数的计算与应用、化学反应速率与化学计量数的关系等知识,涉及的知识点较多,试题综合性强,难度较大,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率.

练习册系列答案
相关题目
化学实验中常将某些溶液或试剂进行酸化或碱化.下列处理中正确的是( )
| A、检验C2H5Br中的Br元素时,将C2H5Br和NaOH溶液混合加热后,加硫酸酸化 |
| B、为提高KMnO4溶液的氧化能力,用浓盐酸将KMnO4溶液酸化 |
| C、检验蔗糖在稀硫酸中水解产生的葡萄糖,应先用NaOH溶液碱化后才能进一步检验 |
| D、检验溶液中是否含有SO42-时,先加氯化钡溶液后,再加稀盐酸酸化 |
将由两种金属单质形成的合金2.2g加入到100mL 2mol/L的硫酸溶液中,有气泡产生且当硫酸浓度降到原浓度的一半时(设溶液体积不变),金属恰好全部溶解,该合金可能的组成为( )
| A、Al和Mg |
| B、Mg和Zn |
| C、Al和Fe |
| D、Fe和Cu |
在100mL 1.0×10-4mol/L的KCl溶液中,加入100mL 2.0×10-6mol/L的AgNO3溶液,下列说法正确的是( )
| A、有AgCl沉淀生成 |
| B、无AgCl沉淀生成 |
| C、有沉淀生成但不是AgCl |
| D、无法确定 |
恒温、恒压下,1mol A和n mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成a molC.则下列说法中正确的是( )
| A、转化的物质A有a mol | ||
B、起始时刻和达平衡时容器中的压强比为(1+n):(1+n-
| ||
| C、当υ正(A)=2υ逆(C)时,可判断反应达平衡 | ||
D、物质B的转化率为
|
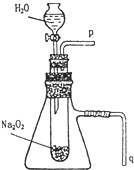 用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.