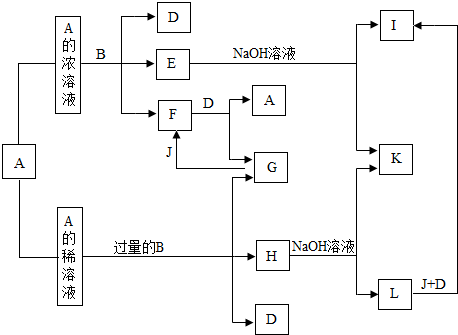
题目内容
16.下列单质或化合物性质的描述正确的是( )| A. | 常温常压下,一氧化氮能与空气中的氧气直接化合 | |
| B. | SiO2与酸、碱均不反应 | |
| C. | Na2O、Na2O2组成元素相同,两化合物都为碱性氧化物 | |
| D. | NO2通入FeSO4溶液中始终无明显现象 |
分析 A、NO能和氧气反应生成NO2;
B、二氧化硅是酸性氧化物;
C、碱性氧化物是能和酸反应只生成盐和水的氧化物;
D、NO2通入水后生成硝酸,有强氧化性.
解答 解:A、常温常压下,NO可与空气中氧气发生反应生成红棕色的二氧化氮气体,故A正确;
B、二氧化硅是酸性氧化物,故能和碱反应生成盐和水,故B错误;
C、碱性氧化物是能和酸反应只生成盐和水的氧化物,Na2O2能和酸反应除了生成盐和水,还生成氧气,故不是碱性氧化物,故C错误;
D、NO2通入水后生成硝酸,有强氧化性,能将Fe2+氧化为Fe3+,溶液颜色由浅绿色变为棕黄色,故D错误.
故选A.
点评 本题考查了常见元素化合物的性质和碱性氧化物的概念,难度不大,应注意的是二氧化硅是酸性氧化物,但能和HF反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.在含有大量的K+、NH4+、Cl-、SO42-的溶液中还可能大量存在的离子是( )
| A. | H+ | B. | Ag+ | C. | OH- | D. | Ba2+ |
11.海水开发利用的部分过程如图所示.下列说法错误的是( )
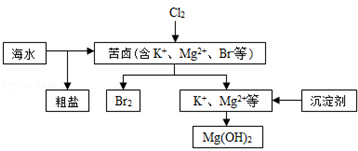

| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂、过滤、蒸发结晶等过程提纯 | |
| C. | 工业生产常选用NaOH作为沉淀剂 | |
| D. | 单质溴可用SO2将其还原吸收 |
1. 一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2符合上述转化关系的A、C可能是①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、SO3 ⑥Na2CO3、CO2( )
一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2符合上述转化关系的A、C可能是①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、SO3 ⑥Na2CO3、CO2( )
 一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2符合上述转化关系的A、C可能是①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、SO3 ⑥Na2CO3、CO2( )
一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2符合上述转化关系的A、C可能是①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、SO3 ⑥Na2CO3、CO2( )| A. | 只有②③④⑥ | B. | 除①外 | C. | 除⑤外 | D. | 全部 |
8.欲除去下列物质中的杂质(括号内为杂质)所用试剂和操作方法都正确的是( )
①Cl2(HCl):饱和食盐水、过滤 ②CO2(SO2):饱和Na2CO3溶液、洗气
③铁粉(铝粉):NaOH溶液、过滤 ④MnO2(KCl):水、溶解后过滤
⑤碳粉(碘单质):CCl4、分液 ⑥C2H5OH(H2O):加新制CaO后蒸馏.
①Cl2(HCl):饱和食盐水、过滤 ②CO2(SO2):饱和Na2CO3溶液、洗气
③铁粉(铝粉):NaOH溶液、过滤 ④MnO2(KCl):水、溶解后过滤
⑤碳粉(碘单质):CCl4、分液 ⑥C2H5OH(H2O):加新制CaO后蒸馏.
| A. | ①②③ | B. | ③④⑥ | C. | ②④⑤ | D. | ①④⑤ |
10.在体积不变的密闭容器中按一定比例通入氮气和氢气,反应合成氨气,该反应放热.欲加快反应的速率同时提高合成氨中H2的转化率,下列措施可行的是( )
| A. | 升高温度 | B. | 适当增大压强 | ||
| C. | 加入催化剂 | D. | 从容器中分离出氨 |
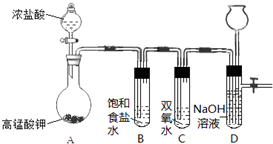 Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证某小组学生设计了如下图所示的实验装置进行实验(夹持装置略去).
Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证某小组学生设计了如下图所示的实验装置进行实验(夹持装置略去). (1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、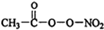 (PAN)等二次污染物.
(PAN)等二次污染物.