题目内容
 某同学为了验证海带中含有碘元素并提取碘单质,拟进行如下实验,请回答相关问题.
某同学为了验证海带中含有碘元素并提取碘单质,拟进行如下实验,请回答相关问题.(1)灼烧.取3g左右的干海带,把干海带表面的附属物用刷子刷净(不要用水冲洗),用剪刀剪碎后,用酒精湿润、放入坩埚中.点燃酒精灯,灼烧海带至完全成灰烬,停止加热.
(2)得到含有I-离子的溶液.操作步骤是(要求用文字回答):
(3)氧化.向操作(2)所得的溶液中加入硫酸酸化的H2O2做氧化剂,使I-氧化为碘单质.选择H2O2做氧化剂,是由于它反应后的产物是水,不会引入新的杂质,同时对环境也不产生污染,而且即使过量时,也是把I-氧化为I2,而不能氧化为碘酸根离子.
H2O2使I-氧化为碘单质的离子方程式是
(4)碘单质的检验.操作步骤是:
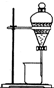
(5)碘单质的萃取.取第(3)步氧化后的溶液于分液漏斗中,向其中加入适量的有机溶剂,振荡、静置后如图所示.“适量”的有机溶剂是指下列的
A.四氯化碳 B.乙醇 C.乙酸
(6)混合液的分离.简述从第(5)步所得的混合液中分离出有机层的操作:
(7)提取碘单质. 把第(6)步所得的有机碘溶液经过蒸馏、升华等方法得到碘单质.
考点:物质的分离、提纯的基本方法选择与应用,海水资源及其综合利用
专题:实验设计题,元素及其化合物
分析:(2)把灰烬倒入盛有适量蒸馏水的烧杯中溶解,再过滤;
(3)H2O2与I-反应生成I2和H2O;
(4)单质碘遇淀粉溶液会变蓝色;
(5)乙醇、乙酸与水互溶,不能作萃取剂;
(6)碘和四氯化碳在下层;打开分液漏斗上部的玻璃塞,使下层液体从下口流出.
(3)H2O2与I-反应生成I2和H2O;
(4)单质碘遇淀粉溶液会变蓝色;
(5)乙醇、乙酸与水互溶,不能作萃取剂;
(6)碘和四氯化碳在下层;打开分液漏斗上部的玻璃塞,使下层液体从下口流出.
解答:
解:(2)灼烧海带得到的灰烬中含有碘离子和不溶于水的物质,把所得的灰烬全部倒入盛有适量蒸馏水的烧杯中,用玻璃棒搅拌,使其充分溶解,得到悬浊液,然后过滤,滤液就是含有I-离子的溶液;
故答案为:把操作(1)最后所得的灰烬全部倒入盛有适量蒸馏水的烧杯中,用玻璃棒搅拌,然后过滤,滤液就是含有I-离子的溶液;
(3)H2O2具有强氧化性能I-氧化为I2同时生成H2O,其反应的离子方程式为:H2O2+2I-+2H+═2H2O+I2;
故答案为:H2O2+2I-+2H+═2H2O+I2;
(4)单质碘遇淀粉溶液会变蓝色,则检验碘单质的操作步骤是取少量操作(3)所得的溶液于干净的小试管中,向其中滴加淀粉溶液,溶液变蓝,则说明有碘单质存在;
故答案为:取少量操作(3)所得的溶液于干净的小试管中,向其中滴加淀粉溶液,溶液变蓝,则说明有碘单质存在;
(5)乙醇、乙酸与水互溶,不能作萃取剂,可以选用四氯化碳作萃取剂;
故答案为:A;
(6)四氯化碳的密度比水大,则碘和四氯化碳在下层;打开分液漏斗上部的玻璃塞,轻轻旋开分液漏斗下部的玻璃活塞,使下层液体慢慢地流出,等液体的分界面恰好流到活塞处时,关上活塞,烧杯中就是含有碘的有机层;
故答案为:打开分液漏斗上部的玻璃塞,轻轻旋开分液漏斗下部的玻璃活塞,使下层液体慢慢地流出,等液体的分界面恰好流到活塞处时,关上活塞,烧杯中就是含有碘的有机层.
故答案为:把操作(1)最后所得的灰烬全部倒入盛有适量蒸馏水的烧杯中,用玻璃棒搅拌,然后过滤,滤液就是含有I-离子的溶液;
(3)H2O2具有强氧化性能I-氧化为I2同时生成H2O,其反应的离子方程式为:H2O2+2I-+2H+═2H2O+I2;
故答案为:H2O2+2I-+2H+═2H2O+I2;
(4)单质碘遇淀粉溶液会变蓝色,则检验碘单质的操作步骤是取少量操作(3)所得的溶液于干净的小试管中,向其中滴加淀粉溶液,溶液变蓝,则说明有碘单质存在;
故答案为:取少量操作(3)所得的溶液于干净的小试管中,向其中滴加淀粉溶液,溶液变蓝,则说明有碘单质存在;
(5)乙醇、乙酸与水互溶,不能作萃取剂,可以选用四氯化碳作萃取剂;
故答案为:A;
(6)四氯化碳的密度比水大,则碘和四氯化碳在下层;打开分液漏斗上部的玻璃塞,轻轻旋开分液漏斗下部的玻璃活塞,使下层液体慢慢地流出,等液体的分界面恰好流到活塞处时,关上活塞,烧杯中就是含有碘的有机层;
故答案为:打开分液漏斗上部的玻璃塞,轻轻旋开分液漏斗下部的玻璃活塞,使下层液体慢慢地流出,等液体的分界面恰好流到活塞处时,关上活塞,烧杯中就是含有碘的有机层.
点评:本题考查了物质的分离和提纯、离子方程式的书写、物质的检验等,侧重于考查学生的实验操作能力,学习中注意掌握萃取操作的方法,题目难度中等.

练习册系列答案
 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
下列各组离子中因有配合离子生成而不能共存的是( )
| A、K+、Na+、Cl-、NO3- |
| B、Mg2+、Ca2+、SO42-、OH- |
| C、Fe2+、Fe3+、H+、NO3- |
| D、Ba2+、Fe3+、Cl-、SCN- |
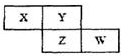 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍