题目内容
8.(1)48g12C18O2分子中的中子数N=26mol.(2)S2-原子核内有16个中子,其质量数为32,则16gS2-所含电子的物质的量为8mol.
(3)某元素的同位素${\;}_{Z}^{A}$X,其氯化物XCl2.取1.11gXCl2溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应.若这种同位素原子核内有20个中子,则:①X元素在周期表中的位置第四周期第ⅡA族.
分析 (1)质量数=质子数+中子数;
(2)在阴离子中,核电荷数=质子数=核外电子数-所带电荷数;
(3)由Cl-+Ag+═AgCl↓计算XCl2的物质的量,再由M=$\frac{m}{n}$计算其摩尔质量,摩尔质量与相对分子质量的数值相等,原子的质量数为原子的近似相对原子质量,结合该原子原子核内有20个中子,根据质子数=质量数-中子数来计算原子的质子数,利用质子数确定元素在周期表中的位置.
解答 解:(1)48g12C18O2分子的物质的量为1mol,12C18O2分子中,N=12-6+(18-8)×2=26,故答案为:26;
(2)1molS2-含电子16mol,16gS2-的物质的量为0.5mol,含电子8mol,故答案为:8;
(3)由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.02L×1mol/L=0.02mol,
n(XCl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.02mol=0.01mol,
则M(XCl2)=$\frac{1.11g}{0.01mol}$=111g/mol,
所以XCl2相对分子质量为111,
所以X的相对原子质量=111-35.5×2=40,即X的质量数为40,
质子数=质量数-中子数=40-20=20,即Z=20,A=40,X为Ca,位于第四周期第ⅡA族,故答案为:第四周期第ⅡA族.
点评 本题考元素周期表的结构及应用,为高频考点,把握发生的离子反应及原子构成为解答的关键,注意分析与应用能力的考查,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
18.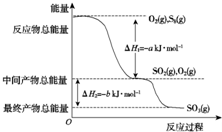 在200℃下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用下图简单表示(图中的△H表示生成1mol含硫产物的数据).由图得出的结论正确的是( )
在200℃下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用下图简单表示(图中的△H表示生成1mol含硫产物的数据).由图得出的结论正确的是( )
 在200℃下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用下图简单表示(图中的△H表示生成1mol含硫产物的数据).由图得出的结论正确的是( )
在200℃下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用下图简单表示(图中的△H表示生成1mol含硫产物的数据).由图得出的结论正确的是( )| A. | S8(s)的燃烧热△H=-8a kJ•mol-1 | |
| B. | 2SO3(g)═2SO2(g)+O2(g)△H=-2b kJ•mol-1 | |
| C. | S8(s)+8O2(g)═8SO2(g)△H=-a kJ•mol-1 | |
| D. | 由1 mol S8(s)生成SO2的反应热△H=-(a+b) kJ•mol-1 |
19.下列解释正确的是( )
| A. | H2O很稳定,是因为水分子之间存在氢键 | |
| B. | HF的熔、沸点在同族元素的氢化物中出现反常,是因为HF分子中有氢键 | |
| C. | 卤素单质从上到下熔沸点升高,是因为它们的组成结构相似,从上到下其摩尔质量增大,分子间的范德华力增大 | |
| D. | 氨气极易溶于水,与氢键没有关系 |
13.在常温常压下,将10mL某气态烃充分燃烧,消耗65mL的氧气,对该烃的下列说法中正确的是( )
| A. | 该烃能使溴水褪色 | B. | 该烃有三种不同的物质 | ||
| C. | 该烃的一氯取代物4种 | D. | 该烃的二氯取代物6种 |
18.下列说法正确的是( )
①石油裂解得到的汽油是纯净物 ②石油裂解能得到乙烯,乙烯是生产聚乙烯的原料
③天然气是一种清洁的化石燃料 ④用酸性高锰酸钾溶液鉴别四氯化碳、环己烯和环己烷
⑤石油产品都可用于聚合反应 ⑥甲烷、苯都属于烃,都不存在同分异构体
⑦煤液化后可以得到甲醇 ⑧煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来.
①石油裂解得到的汽油是纯净物 ②石油裂解能得到乙烯,乙烯是生产聚乙烯的原料
③天然气是一种清洁的化石燃料 ④用酸性高锰酸钾溶液鉴别四氯化碳、环己烯和环己烷
⑤石油产品都可用于聚合反应 ⑥甲烷、苯都属于烃,都不存在同分异构体
⑦煤液化后可以得到甲醇 ⑧煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来.
| A. | ③④⑥⑦⑧ | B. | ②③④⑦ | C. | ③④⑤⑥⑦⑧ | D. | ③④⑦⑧ |
19.科学家发现了一种新元素的原子核内有161个中子,质量数为272,该元素的核电荷数为( )
| A. | 111 | B. | 161 | C. | 272 | D. | 433 |
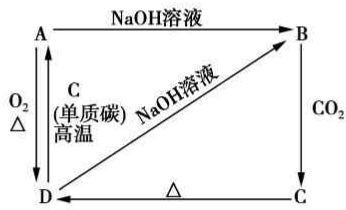 已知A是灰黑色、有金属光泽的固体单质,根据如图所示的组织之间的转化关系,回答下列有关问题
已知A是灰黑色、有金属光泽的固体单质,根据如图所示的组织之间的转化关系,回答下列有关问题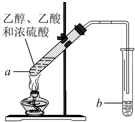 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题.