题目内容
7.将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)═2G(g).若忽略固体体积,平衡时 G 的体积分数随温度和压强的变化如下表所示.请填写下列空格: | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
(2)该反应的熵变△S> 0,△H> 0. (选填“>”、“<”或“=”)
(3)根据表中数据,可计算求得915℃、2.0MPa时E 的转化率为60%.
(4)上述反应达到平衡后,若保持体系温度不变,下列措施中能提高混合体系中气体E 的体积分数的是AD
A.保持容器容积不变,充入一定量的气体 E B.保持容器内压强不变,充入一定量的气体 G
C.加入少量固体F的粉末 D.保持容器容积不变,同时充入一定量的气体 E 和G.
分析 (1)该反应为体积增大的反应,故加压时,平衡逆向移动,G的体积分数减小,从表中第一行数据可得:54.0>a>b,结合表中第3列数据,可确定75.0>a,说明升高温度平衡向正反应方向移动,则f>75.0>a;
(2)正反应气体物质的量增大,为熵增反应,第3列数据中75.0>a,说明升高温度平衡向正反应方向移动,正反应为吸热反应;
(3)设起始时E为a mol,平衡时转化x mol,由于F为固体,对平衡无影响,则平衡时E为(a-x)mol,G为2x mol,再结合G的体积分数列方程确定a、x关系,进而计算E的转化率;
(4)A.保持容器容积不变,充入一定量的气体 E,等效为增大压强,E的体积分数增大;
B.保持容器内压强不变,充入一定量的气体 G,等效为降低压强,
C.加入少量固体F的粉末,不影响平衡移动;
D.保持容器容积不变,同时充入一定量的气体 E 和G,E的含量可能增大.
解答 解:(1)该反应为体积增大的反应,故加压时,平衡逆向移动,G的体积分数减小,从表中第一行数据可得:54.0>a>b,结合表中第3列数据,可确定75.0>a,说明升高温度平衡向正反应方向移动,则f>75.0>a,故b<f,故答案为:<;
(2)正反应气体物质的量增大,为熵增反应,故△S>0,第3列数据中75.0>a,说明升高温度平衡向正反应方向移动,正反应为吸热反应,则△H>0,故答案为:>;>;
(3)设起始时E为a mol,平衡时转化x mol,由于F为固体,对平衡无影响,则平衡时E为(a-x)mol,G为2x mol,则$\frac{2x}{(a-x)+2x}$×100%=75%,解得x=0.6a,所以E的转化率为$\frac{x}{a}$×100%=60%,故答案为:60%;
(4)A.保持容器容积不变,充入一定量的气体 E,等效为增大压强,平衡逆向移动,E的体积分数增大,故A正确;
B.保持容器内压强不变,充入一定量的气体 G,等效为降低压强,平衡正向移动,E的体积分数减小,故B错误,
C.加入少量固体F的粉末,不影响平衡移动,E的体积分数不变,故C错误;
D.保持容器容积不变,同时充入一定量的气体 E 和G,E的含量可能增大,故D正确.
故选:AD.
点评 本题考查化学平衡计算、平衡移动等,旨在考查学生对数据的分析能力、计算能力,难度中等.

| 化学键 | H-H | Cl-Cl | H-Cl |
| 生成(拆开)1mol化学键放出(吸收)的能量 | 436kJ | 243kJ | 431kJ |
| A. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-91.5kJ•mol-1 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=+91.5kJ•mol-1 | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-183kJ•mol-1 | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H=+183kJ•mol-1 |
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4 (g)+4NO2 (g)=4NO(g)+CO2 (g)+2H2 O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2 O(g)△H=-1160kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
A.容器内CO2的浓度保持不变 B.v正(N2)=2v正(NO)
C.容器内压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在该温度下时.该反应的平衡常数为0.56(保留两位小数);
③在30min,改变某一条件,反应重新达到平衡,则改变的条件是减小二氧化碳浓度.
(3)合成塔失去活性的铬锌触媒可用于制备锌锰电池.在碱性条件下,该电池的总反应为:
Zn(s)+2MnO2 (s)+H2O(l)=Zn(OH)2 (s)+Mn2O3(s),该电池正极的电极反应式是2MnO2+2e-+H2O=2OH-+Mn2O3.PbO2 可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取.阳极发生反应的电极反应式为Pb2++2H2O-2e-=PbO2+4H+,阴极上观察到的现象是;石墨上红色物质析出若电解液中不加入Cu(NO3)2这样做的主要缺点是Pb将在阴极析出,Pb2+不能得到有效应用.
| 族 周期 | IA | 0 | |||||||
| 1 | ① | II A | III A | IV A | V A | VI A | VIIA | ||
| 2 | ② | ③ | Ne | ||||||
| 3 | ④ | ⑤ | Al | S | ⑥ | ||||
(2)②的原子结构示意图是
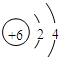 ;
;(3)由①和③两种元素组成的化合物的化学式是NH3;
(4)④和⑤两种元素的金属性强弱顺序是④> ⑤(填“<”或“>”).
(5)④的最高价氧化物对应的水化物与A1(0H)3反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O.
 100mL盐酸与CaCl2混合液中,逐滴加入Na2CO3溶液,生成的沉淀与加入的Na2CO3生成沉淀的质量与加入的Na2CO3生溶液的体积之间的关系如图,已知氯化钙的物质的量浓度为0.025mol/L,
100mL盐酸与CaCl2混合液中,逐滴加入Na2CO3溶液,生成的沉淀与加入的Na2CO3生成沉淀的质量与加入的Na2CO3生溶液的体积之间的关系如图,已知氯化钙的物质的量浓度为0.025mol/L,