题目内容
20.下列说法正确的是( )| A. | Na在空气中长期放置最终变为Na2CO3粉末 | |
| B. | Na2O 和Na2O2都能与水反应生成碱,它们都是碱性氧化物 | |
| C. | 铝与氢氧化钠的反应中水和氢氧化钠均作氧化剂 | |
| D. | 铝箔在空气中受热可以熔化,且发生剧烈燃烧 |
分析 A.Na在空气中长期放置,最终变为碳酸钠粉末;
B.碱性氧化物是指能与酸反应生成盐和水的金属氧化物;
C.Al元素化合价升高,水中H元素的化合价降低;
D.铝箔在空气中受热熔化但不燃烧.
解答 解:A.Na的性质活泼,易与空气中氧气反应生成Na2O,Na2O易与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3•xH2O,Na2CO3•xH2O风化脱水生成Na2CO3,故A正确;
B.因过氧化钠与酸反应生成盐、水和氧气,Na2O2和盐酸反应生成氯化钠、水和氧气,则过氧化钠不属于碱性氧化物,故B错误;
C.在2Al+2NaOH+2H2O═2NaAlO2+3H2反应中,Al元素化合价升高,水中H元素的化合价降低,则该反应中水为氧化剂,故C错误;
D.铝和氧气反应生成了氧化铝,又因三氧化二铝的熔点高于铝的熔点,而三氧化二铝在铝的表面,所以加热铝箔的时候铝失去了光泽,铝熔化了但是不会滴落,不会出现发生剧烈的燃烧,只是金属发红,故D错误;
故选A.
点评 本题主要考查了钠、铝及其化合物的性质,旨在考查学生对基础知识的掌握,氧化还原反应注意把握反应中元素的化合价变化,题目难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
10.25℃时,某一元酸(HB)对应的盐NaB的水溶液呈碱性,下列叙述正确的是( )
| A. | 0.1 mol/L NaB溶液中水电离的OH-浓度大于10-7 mol/L | |
| B. | NaB溶液中:c(Na+)>c(B-)>c(H+)>c(OH-) | |
| C. | NaB溶液中:c(Na+)+c(H+)=c(HB)+c(B-) | |
| D. | HB的电离方程式为:HB═H++B- |
8.下列过程或现象与盐类水解无关的是( )
| A. | NaX溶液的pH>7,则可证明HX属于弱电解质 | |
| B. | 二氯化铁溶液可以做电子工业中铜版的刻蚀液 | |
| C. | 实验室盛放NaF溶液不能用玻璃材质的试剂瓶及玻璃塞 | |
| D. | 浓的硫化钠溶液有强烈的臭味 |
15.某混合气体中可能含有Cl2、O2、SO2、NO、NO2 中的两种或多种气体.现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色.对于原混合气体成分的判断中正确的是( )
| A. | 肯定有SO2 和NO | B. | 肯定有SO2和NO2 | ||
| C. | 可能有Cl2、NO和O2 | D. | 肯定有SO2、NO和O2 |
5.下列实验操作能够达到实验目的是( )
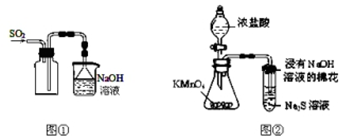

| A. | 实验室采用图①所示装置收集SO2 | |
| B. | 除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤 | |
| C. | 称取0.40 g NaOH,置于100 mL容量瓶中,加水溶解,配制0.10 mol/L NaOH溶液 | |
| D. | 可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱 |
12.下列物质在生活中应用时,起还原作用的是( )
| A. | 明矾作净水剂 | B. | 硅胶做干燥剂 | ||
| C. | 漂粉精作消毒剂 | D. | 铁粉作食品袋内的脱氧剂 |
3.下列说法正确的是( )
| A. | 向pH相同的氨水和氢氧化钠溶液中分别加入适量NH4Cl(s)后,两溶液的pH均减小 | |
| B. | 将Ca(OH)2的饱和溶液加热,pH 和 Ksp均增大 | |
| C. | 25℃时pH=11的NaOH,当温度升高到80℃时,其pH不变 | |
| D. | 用CH3COOH 溶液做导电性实验,灯泡很暗,能证明CH3COOH 是弱电解质 |
 .
. 盐酸、硫酸和硝酸是中学常见的三种酸.
盐酸、硫酸和硝酸是中学常见的三种酸.