题目内容
2.X是日常生活中应用最广泛的金属,现有废铜(杂质为不溶于酸的物质及少量的X单质)来制备胆矾,同时得到副产物红棕色氧化物X.有人设计了如下流程:
请根据上述流程回答下列问题:
(1)写出滤液I中加入H2O2后反应的离子方程式2Fe2++2H++H2O2=2Fe3++2H2O;
(2)试剂a可选用的是BDE(填字母)
A.氨水 B.Cu2(OH)2CO3 C.NaOH D.Cu(OH)2 E.CuCO3
(3)煮沸的目的是除去溶解的二氧化碳.
分析 某金属是日常生活中应用最广泛的金属,为Fe,废铜中含有不溶于酸的杂质及少量Fe,得到的副产物是Fe2O3,废铜酸浸,最后得到胆矾,根据元素守恒知,该酸是硫酸,得到的滤液I中含有硫酸铜、硫酸亚铁,向溶液中加入双氧水,双氧水能氧化亚铁离子生成铁离子,加入试剂a并调节溶液的pH,加入的试剂能使铁离子转化为沉淀且不能引进新的杂质,可以加入和酸反应的物质来调节溶液的pH并且不能产生新的杂质,然后煮沸除去溶液中溶解的气体,将得到的沉淀灼烧得到红棕色氧化物Fe2O3,将溶液蒸发浓缩、冷却结晶、过滤、干燥得到胆矾,结合题目分析解答.
解答 解:某金属是日常生活中应用最广泛的金属,为Fe,废铜中含有不溶于酸的杂质及少量Fe,得到的副产物是Fe2O3,废铜酸浸,最后得到胆矾,根据元素守恒知,该酸是硫酸,得到的滤液I中含有硫酸铜、硫酸亚铁,向溶液中加入双氧水,双氧水能氧化亚铁离子生成铁离子,加入试剂a并调节溶液的pH,加入的试剂能使铁离子转化为沉淀且不能引进新的杂质,可以加入和酸反应的物质来调节溶液的pH并且不能产生新的杂质,然后煮沸除去溶液中溶解的气体,将得到的沉淀灼烧得到红棕色氧化物Fe2O3,将溶液蒸发浓缩、冷却结晶、过滤、干燥得到胆矾,
(1)滤液I中亚铁离子和双氧水发生氧化还原反应生成铁离子和水,加入H2O2后反应的离子方程式2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(2)加入和酸反应的物质来调节溶液的pH并且不能产生新的杂质,BDE都能和酸反应生成硫酸铜且不能引进新的杂质,AC引进新的杂质,故选BDE;
(3)煮沸的目的是除去溶解的二氧化碳,防止生成碳酸铜,故答案为:除去溶解的二氧化碳.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生分析判断能力,涉及基本操作、物质性质、物质分离提纯等知识点,明确流程图中发生的反应及基本操作方法、物质的性质是解本题关键,注意(2)中除杂剂的选取,题目难度不大.

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案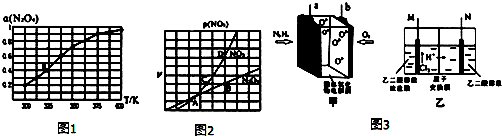
(1)肼(N2H4)与N2O4的反应为:2N2H4(g)+N2O4(1)═3N2(g)+4H2O(g)△H=-1225kJ•mol-1
已知反应相关的化学键键能数据如表:
| 化学键 | N-H | N-N | N≡N | O-H |
| E/(kJ•mol-1) | 390 | 190 | 946 | 460 |
(2)N2O4与NO2之间存在反应N2O4(g)?2NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率,[aN2O4)]随温度变化如图1所示.
①由图推测该反应△H>0(填“>”或“<”),若要提高N2O4的转化率,除改变反应温度外,其它措施有减小体系压强、移出NO2(要求写出一条).
②图中a点对应温度下,已知N2O4的起始压强P0为108kPa,列式计算该温度下反应的平衡常数.Kp=115.2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数.相应的速率-压强关系如图2所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=$\frac{1}{2}$K2.Kp,在图标出的点中,能表示反应达到平衡状态的点为B点与D点.
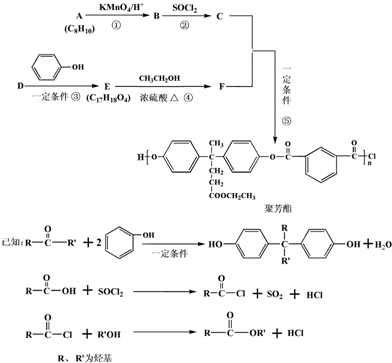
(3)某科研人员设计如图3甲所示新型燃料电池,已知固体电解质可以传导O2-,生成物均为无毒无害的物质.将燃料电池的正负两极与装置乙中M、N两惰性电极连接,两极室均可产生乙醛酸(HOOC-CHO).其中M电极区的乙二醛(OHC-CHO)与电极产物发生反应生成乙醛酸.则:
①燃料电池负极的电极反应式为N2H4+2O2-4e-=N2+2H2O.
②a极与N(填“M”或“N”)相连,写出N极电极反应式HOOC-COOH+2e-+2H+═HOOC-CHO+H2O.
③若有1.5mol H+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1.5mol.
| A. | 用稀硫酸除钢铁表面的铁锈利用了硫酸的酸性 | |
| B. | 干冰用于人工降雨,是利用了干冰升华吸热 | |
| C. | 胃药中含氢氧化镁是因为氢氧化镁能给人提供镁元素 | |
| D. | 碳酸氢钠作焙制糕点的发酵粉是利用了碳酸氢钠能与发醇面团中的酸性物质反应 |
| A. | 8.0gCuO和Cu2S的混合物含铜原子个数为0.2NA | |
| B. | 标准状况下,11.2L乙醇蒸气含共价键数目为4NA | |
| C. | 1molK与O2完全反应生成K2O、K2O2、KO3的混合物,转移电子数为NA | |
| D. | 1L0.2mol•L-1NH4ClO4溶液中含NH4+数目为0.2NA |
| A. | 二氧化硫具有较强的还原性,故不能用浓硫酸干燥 | |
| B. | 苯、溴水、铁粉混合可制成溴苯 | |
| C. | 苯在一定条件下既能发生取代反应,又能发生加成反应,但不能发生氧化反应 | |
| D. | FeCl3溶液可以腐蚀线路板上的Cu,不能说明Cu的金属活动性大于Fe |
 .
. .
.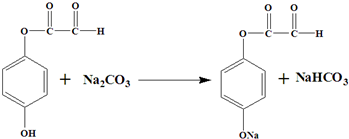 或
或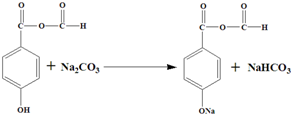 .
.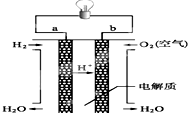 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.