题目内容
4.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )| A. | 1.6gNH2-离子含有的电子数为NA | |
| B. | 20℃、1.0×105Pa时,11.2 L氧气所含的原子数为NA | |
| C. | 标准状况下,2.24LCHCl3含有的共价键数为0.42 NA | |
| D. | 1L 2mol•L-1的硝酸镁溶液中含有的硝酸根离子数为4 NA |
分析 A、求出1.6gNH2-离子的物质的量,然后根据NH2-离子中含10个电子来分析;
B、20℃、1.0×105Pa时,气体摩尔体积大于22.4L/mol;
C、标况下三氯甲烷为液体;
D、求出硝酸镁的物质的量,然后根据1mol硝酸镁中含2mol硝酸根来分析.
解答 解:A、1.6gNH2-离子的物质的量为0.1mol,而NH2-离子中含10个电子,故0.1mol中含NA个电子,故A正确;
B、20℃、1.0×105Pa时,气体摩尔体积大于22.4L/mol,故11.2L氧气的物质的量小于0.5mol,则含有原子个数小于NA个,故B错误;
C、标况下三氯甲烷为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、1L2mol/L硝酸镁的物质的量为n=CV=2mol/L×1L=2mol,而1mol硝酸镁中含2mol硝酸根,故2mol硝酸镁中含4mol硝酸根,个数为4NA个,故D正确.
故选AD.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
12.关于阿伏加德罗常数(NA),下列说法不正确的是( )
| A. | 1 mol氮气和NA个一氧化碳分子的质量相等 | |
| B. | NA个O2分子和NA个O3分子的质量相等 | |
| C. | NA个O2和NA个H2的质量比为16:1 | |
| D. | 质量同为16 g的O2、O3中都含有的氧原子数目相同 |
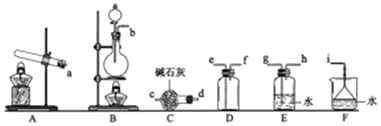
19.下列实验操作或装置(略去部分加持仪器)正确的是( )
| A. | 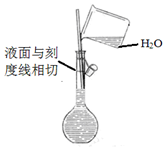 配制溶液 | B. | 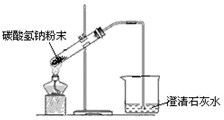 碳酸氢钠受热分解 | ||
| C. | 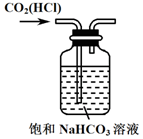 除去CO2中的HCl | D. | 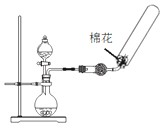 制备收集干燥氨气 |
13.将过量的SO2通入下列溶液中,都能出现浑浊的组合是( )
①Ca(OH)2;②BaCl2;③Na2SiO3;④Ba(NO3)2;⑤苯酚钠;⑥Na2CO3 .
①Ca(OH)2;②BaCl2;③Na2SiO3;④Ba(NO3)2;⑤苯酚钠;⑥Na2CO3 .
| A. | ①②③⑥ | B. | ②⑤⑥ | C. | ③④⑤⑥ | D. | ③④⑤ |
14.2.48g铁铜合金完全溶解于80mL 4.0mol•L-1稀硝酸中,得到标准状况下672mL NO气体(假设此时无其他气体产生),下列说法正确的是( )
| A. | 取反应后溶液,滴入几滴KSCN溶液,无血红色出现 | |
| B. | 该合金中铁与铜的物质的量之比是1:2 | |
| C. | 反应后溶液(忽略溶液体积变化)中c(H+)=2.5 mol•L-1 | |
| D. | 向反应后的溶液中加入2.0 mol•L-1NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是120 mL |
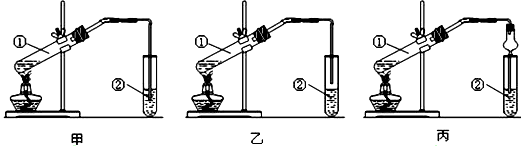
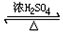 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;