题目内容
5.二氯亚砜(SOCl2)是一种无色易挥发液体,熔点-105℃,沸点79℃,140℃以上易分解,遇水剧烈反应生成SO2与HCl,常用作脱水剂.(1)SOCl2遇水发生反应的化学方程式SOCl2+H2O=SO2↑+2HCl↑.
(2)甲同学用下图装置制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略):
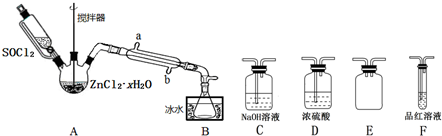
①装置的连接顺序为A→B→D→F→E→C.
②搅拌的作用是增大接触面积,加快脱水速率,适合A的加热方式是水浴加热,冷凝管的进水口是b.(填“a”或“b”)
③一段时间后,F中观察到的现象是品红溶液褪色,C中新增的阴离子可能有SO32-、Cl-、HSO3-.
④实验结束后,为检测ZnCl2•xH2O是否完全脱水,称取蒸干后的固体a g溶于水,加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg,若$\frac{b}{a}$=2.1(保留一位小数),即可证明ZnCl2•xH2O已完全脱水.
⑤乙同学认为直接将ZnCl2•xH2O置于坩埚中加热即可得到无水ZnCl2,你认为这种方法是否可行,并说明原因:不可行,因为ZnCl2加热时水解.
(3)若用SOCl2作FeCl3•6H2O的脱水剂,设计实验证明脱水时发生了氧化还原反应.
实验方案如下:取少量FeCl3•6H2O于试管中,加入过量SOCl2,振荡;方法一:往试管中加水溶解,滴加BaCl2溶液,若生成白色沉淀,则证明脱水过程发生了氧化还原反应;
方法二:往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程发生了氧化还原反应;
方法三:往试管中加水溶解,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀,则证明脱水过程发生了氧化还原反应..
分析 (1)SOCl2遇水剧烈反应生成SO2与HCl;
(2)①A中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,防止溶液中水蒸气加入B中,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气种二氧化硫与HCl,防止污染环境,E装置防止倒吸;
②搅拌可以增大接触面积,加快反应速率;温度过高SOCl2会分解,应采取水浴加热,受热均匀,便于控制温度;应整个冷凝管充满冷凝水,充分冷却;
③二氧化硫具有漂白性;氢氧化钠溶液吸收二氧化硫、HCl;
④ZnCl2•xH2O完全脱水得到ZnCl2,则ag为ZnCl2的质量,溶于水后加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg为AgCl的质量,结合氯离子守恒计算;
⑤ZnCl2加热时会水解为氢氧化锌与HCl,氢氧化锌受热分解为ZnO;
(3)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,可以检验硫酸根、亚铁离子或铁离子判断.
解答 解:(1)SOCl2遇水剧烈反应生成SO2与HCl,反应方程式为:SOCl2+H2O=SO2↑+2HCl↑,
故答案为:SOCl2+H2O=SO2↑+2HCl↑;
(2)①A中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,防止溶液中水蒸气加入B中,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气种二氧化硫与HCl,防止污染环境,E装置防止倒吸,装置的连接顺序为A→B→D→F→E→C,
故答案为:D,F,E,C;
②搅拌可以增大接触面积,加快脱水速率;温度过高SOCl2会分解,应采取水浴加热,受热均匀,便于控制温度;应整个冷凝管充满冷凝水,充分冷却,应从b口进水,
故答案为:增大接触面积,加快脱水速率;水浴加热;b;
③二氧化硫具有漂白性,一段时间,可以观察到F中品红溶液褪色,氢氧化钠溶液吸收二氧化硫、HCl,新增的阴离子可能有SO32-、Cl-、HSO3-,
故答案为:品红溶液褪色;SO32-、Cl-、HSO3-;
④ZnCl2•xH2O完全脱水得到ZnCl2,则ag为ZnCl2的质量,溶于水后加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg为AgCl的质量,由氯离子守恒:$\frac{ag}{136g/mol}$×2=$\frac{bg}{143.5g/mol}$,整理可得$\frac{b}{a}$=2.1,
故答案为:2.1;
⑤ZnCl2加热时会水解为氢氧化锌与HCl,氢氧化锌受热分解为ZnO,不能得到ZnCl2,该方案不可行,
故答案为:不可行,因为ZnCl2加热时水解;
(3)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,实验证明脱水时发生了氧化还原反应方案为:
方法一:往试管中加水溶解,滴加BaCl2溶液,若生成白色沉淀,则证明脱水过程发生了氧化还原反应;
方法二:往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程发生了氧化还原反应;
方法三:往试管中加水溶解,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀,则证明脱水过程发生了氧化还原反应,
故答案为:方法一:往试管中加水溶解,滴加BaCl2溶液,若生成白色沉淀,则证明脱水过程发生了氧化还原反应;
方法二:往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程发生了氧化还原反应;
方法三:往试管中加水溶解,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀,则证明脱水过程发生了氧化还原反应.
点评 本题考查物质制备实验、实验方案设计、对原理与操作的分析与评价、化学计算等,关键是对实验原理的理解,较好地考查学生实验能力、计算能力、知识迁移运用能力.

| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| D. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 |
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6.-2 | -1 | -1 |
| A. | 气态氢化物的稳定性HG>HF>H2E | |
| B. | B2+、D3+、E2-、G-四种离子的核外电子排布相同 | |
| C. | A、E元素与氧元素可以形成三种常见的含氧酸盐 | |
| D. | F、G元素的氢化物沸点G>F |
| A. | 元素周期表中X位于Y的上一周期 | |
| B. | X的含氧酸的酸性强于Y的含氧酸的酸性 | |
| C. | 将H2X、HY分别加热至500℃,只有HY发生分解 | |
| D. | Xn-的还原性强于Ym- |
| A. | L层上的电子数为奇数的元素一定是主族元素 | |
| B. | 族序数等于周期序数的元素一定是金属元素 | |
| C. | 由不同种元素组成的多原子分子里,一定只存在极性键 | |
| D. | 共价化合物只含有共价键,离子化合物只含有离子键 |
 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
 .
.
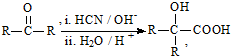 (R、R′代表烃基)
(R、R′代表烃基) .
. .
. .
.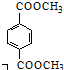 与足量NaOH溶液反应时,最多消耗4molNaOH
与足量NaOH溶液反应时,最多消耗4molNaOH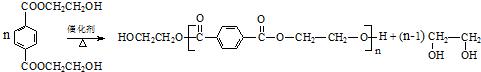 .
.