题目内容
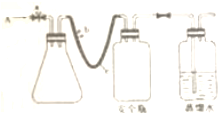 实验室用下列方法测定某水样中O2的含量
实验室用下列方法测定某水样中O2的含量(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnOuOH)2,再用I-将生成的MnOuOH)2再还原为Mn2+,反应的离子方程为:
已知:
①Mn2++O2+4OH-=2MnO(OH)2
②I2+2Na2S2O3=2NaI+Na2S4O6
③2S2O
2- 3 |
(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓如过量N2,此操作的目的是
②有注射器抽取某水样20.00mL从A处注入锥形瓶
③在肺部从A处注入含mmolNaOH的溶液及过量MnSO4溶液
④完成上述操作后,关闭a,b将锥形瓶中的溶液充分振荡
⑤打开止水夹a,b分别从A处注入足量NaI溶液nmolH2SO4的硫酸溶液接近中性.
⑥重复④的操作
⑦去下锥形瓶向其中加入2-3滴
⑧用0.005mol.L-1Na2S2O3滴定至终点
(3)数据分析
①若在滴定过程中消耗的Na2S2O3标准溶液体积为3.60mL,则此水样中氧气(O2)的含量为
③实验要求加入适量的H2SO4使溶液接近中性,其原因是
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)根据题中反应物和生成物,利用化合价升降相等配平;
(2)①测定的是水样中氧气含量,必须将装置中的空气赶走,避免干扰测定结果;
⑦根据反应中有碘单质参与,利用碘遇到淀粉显示蓝色的特性,使用淀粉做指示剂;
(3)①根据反应原理找出反应的关系式,计算出试样中的氧含量;
②滴定管没有润洗,导致标准液浓度减小,消耗的标准液体积变大,氧气含量偏大;
③根据反应原理及硫代硫酸钠能够与酸反应分析.
(2)①测定的是水样中氧气含量,必须将装置中的空气赶走,避免干扰测定结果;
⑦根据反应中有碘单质参与,利用碘遇到淀粉显示蓝色的特性,使用淀粉做指示剂;
(3)①根据反应原理找出反应的关系式,计算出试样中的氧含量;
②滴定管没有润洗,导致标准液浓度减小,消耗的标准液体积变大,氧气含量偏大;
③根据反应原理及硫代硫酸钠能够与酸反应分析.
解答:
解:(1)溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,锰元素化合价升高2价,氧气化合价降低了4价,根据化合价升高降低相等配平反应的离子方程式为:2Mn2++O2+4OH-=2MnO(OH)2,
故答案为:2Mn2++O2+4OH-=2MnO(OH)2;
(2)①由于测定的是水样中氧气含量,必须将装置中的空气赶走,避免干扰测定结果,
故答案为:赶走装置内空气,避免空气中的O2的干扰;
⑦由于反应中有碘单质参与,利用碘遇到淀粉显示蓝色的特性,可以选用淀粉做指示剂,
故答案为:淀粉溶液;
(3)①发生的反应有:2Mn2++O2+4OH-=2MnO(OH)2、MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2Na2S2O3=2NaI+Na2S4O6,
氧气反应的关系式为:O2~2MnO(OH)2~2I2~4Na2S2O3,
1000mL水样中含有的氧气的物质的量是:n(O2)=
n(Na2S2O3)×
=0.25×0.005mol?L-1×0.0039L×50=2.4375×10-4mol,
氧气的质量为:2.4375×10-4mol×32g/mol=7.8mg,
此水样中氧(O2)的含量为7.8mg?L-1,
故答案为:7.8mg?L-1;
②若未用Na2S2O3 标准溶液润洗滴定管,会导致标准液的浓度减小,消耗的标准液的体积增大,测定结果偏大,
故答案为:偏大
③由于加入稀H2SO4使MnO(OH)2充分转化为Mn2+,但加入稀H2SO4的量时不宜过多,否则后续滴定过程中Na2S2O3与过量的酸反应导致消耗的Na2S2O3溶液偏大,导致消耗的Na2S2O3溶液偏大;
故答案为:若碱过量,则Mn(OH)2不能全部转变为Mn2+,而酸过量时,滴定过程中Na2S2O3可与酸反应导致消耗的Na2S2O3溶液偏大.
故答案为:2Mn2++O2+4OH-=2MnO(OH)2;
(2)①由于测定的是水样中氧气含量,必须将装置中的空气赶走,避免干扰测定结果,
故答案为:赶走装置内空气,避免空气中的O2的干扰;
⑦由于反应中有碘单质参与,利用碘遇到淀粉显示蓝色的特性,可以选用淀粉做指示剂,
故答案为:淀粉溶液;
(3)①发生的反应有:2Mn2++O2+4OH-=2MnO(OH)2、MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2Na2S2O3=2NaI+Na2S4O6,
氧气反应的关系式为:O2~2MnO(OH)2~2I2~4Na2S2O3,
1000mL水样中含有的氧气的物质的量是:n(O2)=
| 1 |
| 4 |
| 1000 |
| 20 |
氧气的质量为:2.4375×10-4mol×32g/mol=7.8mg,
此水样中氧(O2)的含量为7.8mg?L-1,
故答案为:7.8mg?L-1;
②若未用Na2S2O3 标准溶液润洗滴定管,会导致标准液的浓度减小,消耗的标准液的体积增大,测定结果偏大,
故答案为:偏大
③由于加入稀H2SO4使MnO(OH)2充分转化为Mn2+,但加入稀H2SO4的量时不宜过多,否则后续滴定过程中Na2S2O3与过量的酸反应导致消耗的Na2S2O3溶液偏大,导致消耗的Na2S2O3溶液偏大;
故答案为:若碱过量,则Mn(OH)2不能全部转变为Mn2+,而酸过量时,滴定过程中Na2S2O3可与酸反应导致消耗的Na2S2O3溶液偏大.
点评:本题考查了水样中氧气含量的测定,涉及的内容较多,本题难度较大,需要分析实验原理并联系滴定知识合理完成,充分考查了学生的分析、理解能力.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
A+、B2+、C-、D2-四种离子具有相同的电子层结构.现有下列排列顺序,四种离子的半径由大到小及四种元素原子序数由大到小的顺序分别是( )
①B2+>A+>C->D2-
②C->D2->A+>B2+
③B2+>A+>D2->C-
④D2->C->A+>B2+.
①B2+>A+>C->D2-
②C->D2->A+>B2+
③B2+>A+>D2->C-
④D2->C->A+>B2+.
| A、①② | B、④① | C、②③ | D、③② |
X、Y、Z代表三种元素的原子,X、Y有相同的电子层,Y、Z最外层电子数相同,已知三种元素的原子最外层电子数之和为17,三种元素的质子数之和为31.则X、Y、Z可能是( )
| A、N、O、S |
| B、Cl、N、P |
| C、Be、F、Cl |
| D、F、N、P |
下列各项表述与示意图一致,且文字图示均正确的是( )
A、 表示第三周期元素原子半径的变化规律 表示第三周期元素原子半径的变化规律 |
B、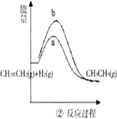 a、b曲线分别表示反应:CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0在使用和未使用催化剂时,反应过程中的能量变化 |
C、 实验用于测定稀盐酸的浓度 |
D、 实验可用于验证HCl在水中的溶解性 |
下列说法中,正确的是( )
| A、NH3是碱性气体,能使酚酞溶液变红色 |
| B、SiO2是酸性氧化物,不溶于任何酸 |
| C、SO2具有漂白性,能使溴水褪色 |
| D、浓H2SO4具有吸水性,能使蔗糖发生炭化 |
如图表示4-溴环己烯所发生的4个不同反应.其中,产物只含一种官能团的反应是( )


| A、①④ | B、③④ | C、②③ | D、①② |
 用如图所示的装置进行实验:
用如图所示的装置进行实验: