��Ŀ����
Ϊȷ��ij���ȼ���Ʒ������������������ɣ��ֱ��������ʵ�飺
��1����ȡ10.7g����Ʒ�������м���������NaOH��Һ��������ɵ����壨��״������ͬ�����Ϊa L����Ʒ��������������w��Al��= �����ú�a�ı���ʽ��ʾ����������Ʒ���ڸ�����ǡ�÷�����ȫ��Ӧ����a= L��
��2������1���з�Ӧ������ȴ�����������ᣬ������ɵ��������Ϊb L���������루1������������������b��a= ��
��3������ȡ10.7g����Ʒ������Ʒ�ڸ�������Ȼǡ����ȫ��Ӧ�������м���1.0mol�ML����Vml������ǡ���ܽ���ȫ�����������V����СֵΪ ��
��1����ȡ10.7g����Ʒ�������м���������NaOH��Һ��������ɵ����壨��״������ͬ�����Ϊa L����Ʒ��������������w��Al��=
��2������1���з�Ӧ������ȴ�����������ᣬ������ɵ��������Ϊb L���������루1������������������b��a=
��3������ȡ10.7g����Ʒ������Ʒ�ڸ�������Ȼǡ����ȫ��Ӧ�������м���1.0mol�ML����Vml������ǡ���ܽ���ȫ�����������V����СֵΪ
���㣺̽�����ʵ���ɻ�������ʵĺ���
ר�⣺
��������1������NaOH��Ӧ�Ļ�ѧ����ʽΪ2Al+2NaOH+2H2O=2NaAlO2+3H2����n��H2��=
�����ݻ�ѧ����ʽ���㣻ȡͬ��������Ʒ���ڸ�����ʹ��ǡ�÷�Ӧ��������2Al+Fe2O3
2Fe+Al2O3�����ݷ���ʽ�ɼ���10.7g��Ʒ�к���Al�����ʵ������ɸ��ݷ���ʽ������������������
��2����1���з�Ӧ����������Fe���ɸ����������ʵ���������������������������������ȣ�
��3��ȡ10.7g��Ʒ�����ȼ��ǡ����ȫ��Ӧ���������ȷ�Ӧ���������������ᷴӦ������������Ӧ�ķ���ʽ���㣮
| aL |
| 22.4L/mol |
| ||
��2����1���з�Ӧ����������Fe���ɸ����������ʵ���������������������������������ȣ�
��3��ȡ10.7g��Ʒ�����ȼ��ǡ����ȫ��Ӧ���������ȷ�Ӧ���������������ᷴӦ������������Ӧ�ķ���ʽ���㣮
���
�⣺��1������NaOH��Ӧ�Ļ�ѧ����ʽΪ2Al+2NaOH+2H2O=2NaAlO2+3H2����n��H2��=
=
mol��
2Al+2NaOH+2H2O=2NaAlO2+3H2��
2mol 3mol
n��Al��
mol
n��Al��=
mol=
mol��
m��Al��=27g/mol��
mol=
g��
�أ�Al��=
��100%�T7.5a%
ȡͬ��������Ʒ���ڸ�����ʹ��ǡ�÷�Ӧ��������2Al+Fe2O3
2Fe+Al2O3��
���������xmolAl��ymolFe2O3��
����
��֮�ã�x=0.1��y=0.05��
2Al+2NaOH+2H2O=2NaAlO2+3H2��
2mol 3��22.4lL
0.1mol aL
a=
=3.36��
�ʴ�Ϊ��0.075a��3.36��
��2���ɣ�1��֪n��Fe��=0.1mol��
Fe+2HCl=FeCl2+H2��
1mol 22.4L
0.1mol bL
b=2.24��
����a��b=3.36��2.24=3��2��
�ʴ�Ϊ��2��3��
��3�����������֪�����ʵ���Ϊ0.1mol�������������ڸ�����������������������Ӧ����ʽΪ2Al+Fe2O3
2Fe+Al2O3���ɶ���ǡ�÷�Ӧ�����ݷ���ʽ��֪��
0.1molAl������0.1molFe��0.05molAl2O3�������ᷴӦ�������м���1.0mol�ML����Vml������ǡ���ܽ���ȫ��
Fe+2HCl=FeCl2+H2��
0.1mol 0.2mol
Al2O3+6HCl=2AlCl3+3H2O
0.05mol 0.3mol
����HCl���ʵ���Ϊ0.5mol�����������V����Сֵ=
=0.5L=500mL��
�ʴ�Ϊ��500mL��
| aL |
| 22.4L/mol |
| a |
| 22.4 |
2Al+2NaOH+2H2O=2NaAlO2+3H2��
2mol 3mol
n��Al��
| a |
| 22.4 |
n��Al��=
| 2a |
| 3��22.4 |
| a |
| 33.6 |
m��Al��=27g/mol��
| a |
| 33.6 |
| 27a |
| 33.6 |
�أ�Al��=
| ||
| 10.7g |
ȡͬ��������Ʒ���ڸ�����ʹ��ǡ�÷�Ӧ��������2Al+Fe2O3
| ||
���������xmolAl��ymolFe2O3��
����
|
��֮�ã�x=0.1��y=0.05��
2Al+2NaOH+2H2O=2NaAlO2+3H2��
2mol 3��22.4lL
0.1mol aL
a=
| 0.1mol��3��22.4L |
| 2mol |
�ʴ�Ϊ��0.075a��3.36��
��2���ɣ�1��֪n��Fe��=0.1mol��
Fe+2HCl=FeCl2+H2��
1mol 22.4L
0.1mol bL
b=2.24��
����a��b=3.36��2.24=3��2��
�ʴ�Ϊ��2��3��
��3�����������֪�����ʵ���Ϊ0.1mol�������������ڸ�����������������������Ӧ����ʽΪ2Al+Fe2O3
| ||
0.1molAl������0.1molFe��0.05molAl2O3�������ᷴӦ�������м���1.0mol�ML����Vml������ǡ���ܽ���ȫ��
Fe+2HCl=FeCl2+H2��
0.1mol 0.2mol
Al2O3+6HCl=2AlCl3+3H2O
0.05mol 0.3mol
����HCl���ʵ���Ϊ0.5mol�����������V����Сֵ=
| 0.5mol |
| 1.0mol/L |
�ʴ�Ϊ��500mL��
���������⿼�����ȷ�Ӧ�Լ���ѧ����ʽ�ļ��㣬��Ŀ�Ѷ��еȣ�����ע�����ȷ�Ӧ��ԭ����ע����ط���ʽ����д�Լ����ʵ���Ӧ���ڻ�ѧ����ʽ�ļ��㷽����

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
���ڳ��ڷ����ڿ����е����и������ʵ�����������ǣ�������
| A������Na��NaOH���ն�����Na2CO3 |
| B��ŨH2SO4��Ũ�����Ũ�ȶ����С |
| C��ˮ�����Ͳ��������ȶ���������� |
| D����ʯ�Һͼ�ʯ�Ҷ���������е�CO2��Ӧ |
���й���Ԫ�������ɺ�Ԫ�����ڱ���˵������ȷ���ǣ�������
| A��Ŀǰ���ֵ�����Ԫ��ռ�������ڱ���ȫ��λ�ã������������µ�Ԫ�ر����� |
| B��Ԫ�ص���������ԭ�����������Ӷ��������Ա仯 |
| C��������ѧ�ҵ�����ΪԪ�����ڱ��Ľ��������˾��� |
| D������������Ϊ8��������ϡ������Ԫ�ص�ԭ�� |
���л�ѧ������д��ȷ���ǣ�������
A����ԭ�ӵĽṹʾ��ͼ�� | ||
B��H2O���ӵı���ģ�ͣ� | ||
C����Ϊ���ԭ�������ⶨ����̼���أ�
| ||
D���õ���ʽ��ʾ�Ȼ�����ӵ��γɹ��̣� |
һ���¶Ⱥ�һ��������ܱ������з������·�Ӧ��A2��s��+B2��g��?2AB��g������Ӧ�ﵽƽ��״̬�ı�־�ǣ�������
| A��V����B2���T2V����AB�� |
| B����λʱ��������2molAB��ͬʱ����1mol��B2 |
| C�������ڵ���ѹǿ����ʱ����仯 |
| D�������ܶȲ�����ʱ��仯���仯 |
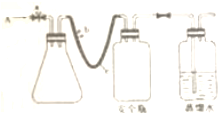 ʵ���������з����ⶨijˮ����O2�ĺ���
ʵ���������з����ⶨijˮ����O2�ĺ���
 �ش���������л�ʵ������⣮
�ش���������л�ʵ������⣮