题目内容
12. 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.Ⅰ:甲同学在a、b、c三只烧杯里分别加入50mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象.甲同学设计实验的目的是验证锂、钠、钾的金属性强弱,反应最剧烈的烧杯是c(填a、b、c).
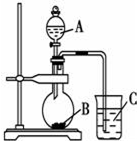
Ⅱ:乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证氮、碳、硅元素的非金属性强弱.乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.
(1)写出所选用物质的化学式:A:HNO3;B:CaCO3;C:Na2SiO3.
(2)写出烧杯中发生反应的离子方程式:CO2+SiO32-+H2O═H2SiO3↓+CO32-.
分析 Ⅰ由“研究性学习小组设计了一组实验验证元素周期律”可知,甲同学设计实验的目的是验证锂、钠、钾的金属性强弱;
金属性越强,单质与水反应越剧烈;
Ⅱ利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,据此解答.
解答 解:Ⅰ由“研究性学习小组设计了一组实验验证元素周期律”可知,甲同学设计实验的目的是验证锂、钠、钾的金属性强弱;
金属性K>Na>Li,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是c,
故答案为:验证锂、钠、钾的金属性强弱;c;
Ⅱ(1)利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,
故答案为:HNO3;CaCO3;C:Na2SiO3;
(2)烧杯中发生反应的离子方程式为:CO2+SiO32-+H2O═H2SiO3↓+CO32-,
故答案为:CO2+SiO32-+H2O═H2SiO3↓+CO32-.
点评 本题将元素及其化合物、元素周期律与实验知识结合起来,考查了审题能力、思维能力,具有较强的综合性,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列化学事实及其解释都正确的是( )
| A. | 滴有酚酞的碳酸氢钠溶液显红色,微热后红色加深,是因为碳酸氢钠分解生成了碳酸钠 | |
| B. | 用洁净的玻璃管向包有过氧化钠的脱脂棉吹气,脱脂棉燃烧,说明二氧化碳、水与过氧化钠的反应是放热反应 | |
| C. | 向溴水中滴入植物油,振荡后油层显无色,说明溴不溶于油脂 | |
| D. | 粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
20.下列有关元素周期表结构的说法正确的是( )
| A. | 原子最外层电子数为2的元素一定处于周期表IIA族 | |
| B. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| C. | 某元素原子核外的电子数为63,则它是第6周期副族元素 | |
| D. | 除短周期外,其他周期均为18种元素,副族元素没有非金属元素 |
17.将NaIO3溶液逐滴加入含5mol NaHSO3的溶液中,依次发生反应:①IO3-+HSO3-→I-+SO42-+H+;②IO3-+I-+H+→I2+H2O(方程式均未配平).当溶液中I-和I2的物质的量之比为a:1时,加入的NaIO3的物质的量是( )
| A. | $\frac{5a+10}{3a+5}$mol | B. | $\frac{3a+5}{5a+10}$mol | C. | $\frac{5}{9a+15}$mol | D. | $\frac{9a+15}{5}$mol |
1.下列关于Mg(OH)2制备和性质的离子方程式,不正确的是( )
| A. | 由MgCl2溶液和NaOH溶液制备Mg(OH)2:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 向Mg(OH)2悬浊液中滴加浓FeCl3溶液,生成红褐色沉淀:3Mg(OH)2 (s)+2Fe3+═2Fe(OH)3(s)+3Mg2+ | |
| C. | 向Mg(OH)2悬浊液中滴加浓NH4Cl溶液,浊液变澄清:Mg(OH)2+2NH4+═2NH3•H2O+Mg2+ | |
| D. | 向Mg(OH)2悬浊液中滴加醋酸,浊液变澄清:Mg(OH)2+2H+═Mg2++2H2O |
2.下面的排序不正确的是( )
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 晶格能由大到小:NaF>NaCl>NaBr>NaI | |
| D. | 熔点由高到低:Na>Mg>Al |

 .
. .
.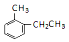 的名称是2-甲基乙苯.
的名称是2-甲基乙苯. +CH3COOH$?_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.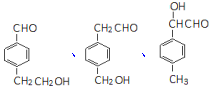 任一种.
任一种.