题目内容
19.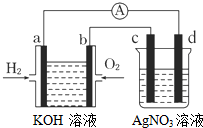 氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极),下列叙述正确的是( )
氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极),下列叙述正确的是( )| A. | a电极是负极,OH-移向正极 | |
| B. | b电极的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 燃料电池中电解质溶液的pH保持不变 | |
| D. | d电极有气体放出 |
分析 左边装置能自发的进行氧化还原反应,属于原电池,通入氢气的电极a是负极、通入氧气的电极b是正极,a电极反应式为H2-2e-+2OH-=2H2O、b电极反应式为O2+4e-+2H2O=4OH-;右边装置有外接电源,所以属于电解池,c是阳极、d是阴极,d电极上Ag+得电子生成Ag.
解答 解:左边装置能自发的进行氧化还原反应,属于原电池,通入氢气的电极a是负极、通入氧气的电极b是正极,右边装置有外接电源,所以属于电解池,c是阳极、d是阴极,
A.a是负极、b是正极,电解质溶液中阴离子向负极移动,则OH-移向负极,故A错误;
B.a电极反应式为H2-2e-+2OH-=2H2O、b电极反应式为O2+4 e-+2H2O=4OH-,故B正确;
C.燃料电池反应式为2H2+O2=2H2O,溶液中n(KOH)不变,因为有水生成导致溶液体积增大,则溶液中c(KOH)减小,溶液的pH减小,故C错误;
D.d电极上Ag+得电子生成Ag,电极反应式为Ag++e-=Ag,故D错误;
故选B.
点评 本题考查原电池和电解池原理,为高频考点,正确判断各个电极名称及各个电极上发生的反应是解本题关键,易错选项是C,注意:虽然KOH不参加反应但溶液体积增大导致溶液的pH发生变化,题目难度不大.

练习册系列答案
相关题目
11.根据反应2Fe3++2I-?2Fe2++I2设计原电池如下图所示,判断下列说法正确的是( )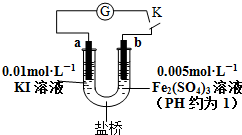

| A. | 电流计G指针指向零时,说明U形管中反应达到平衡状态 | |
| B. | 当电路中电流为零时,增加KI溶液的浓度,则a极为正极 | |
| C. | 当U形管b端颜色逐渐加深时,说明b极为负极 | |
| D. | 盐桥中阳离子一定向右移动 |
 .
.
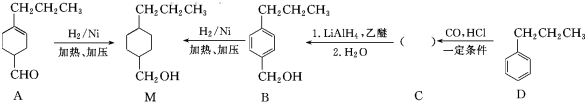
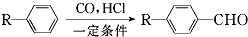
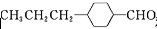 和
和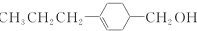 (写结构简式)生成.
(写结构简式)生成.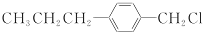 .
.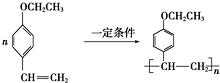 .
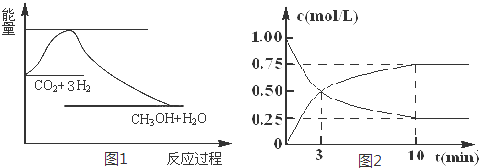
.

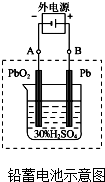 (1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O
(1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O