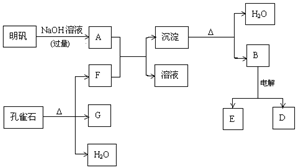
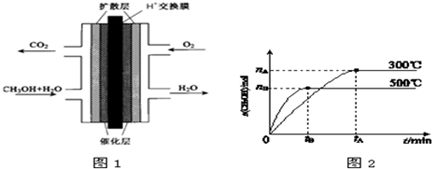
题目内容
6. 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.(1)此时溶液的溶质若是单一成分,可能是Na2CO3或NaHCO3;
(2)在上述所得溶液中,逐滴缓慢滴加1mol/L的盐酸,所得气体的体积与所加盐酸的体积
(不考虑溶解于水)关系如图所示.
①B点时,产生的CO2在标准状况下的体积为2240mL
②B点时,反应所得溶液中溶质的物质的量浓度是0.75mol/L(溶液体积的变化忽略不计)
分析 (1)CO2与NaOH反应可生成Na2CO3或NaHCO3,二者溶液都呈碱性;
(2)加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→B段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O→A段消耗的盐酸为A→B消耗的盐酸的二倍,应为NaOH和Na2CO3的混合物.
①根据AB段消耗氯化氢溶液的体积、结合方程式计算生成二氧化碳的体积;
②B点溶液中溶质为NaCl,由钠离子守恒可知n(NaCl)=n(NaOH),进而计算氯化钠的浓度.
解答 解:(1)CO2与NaOH反应可生成Na2CO3或NaHCO3,二者溶液都呈碱性,则如果是单一成分,可能是Na2CO3或NaHCO3,
故答案为:Na2CO3或NaHCO3;
(2)加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→B段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O-A段消耗的盐酸为A→B的二倍,反应产物应为NaOH和Na2CO3的混合物,二者都可与盐酸反应,反应的离子方程式分别为:OH-+H+═H2O、CO32-+H+═HCO3-;
①AB段消耗HCl为0.1L×1mol/L=0.1mol,由NaHCO3+HCl═NaCl+H2O+CO2↑,可知生成二氧化碳的物质的量为0.1mol,标况下0.1mol二氧化碳的体积为:22.4L/mol×0.1mol=2.24L=2240mL,
故答案为:2240mL;
②B点溶液中溶质为NaCl,由钠离子守恒可知n(NaCl)=n(NaOH)=0.1L×3mol/L=0.3mol,则NaCl的物质的量浓度是:$\frac{0.3mol}{0.1L+0.3L}$=0.75mol/L,
故答案为:0.75mol/L.
点评 本题考查混合物的计算,题目难度中等,关键是根据图象分析各阶段发生的反应,注意计算过程中守恒思想的应用.

| A. | 1:6 | B. | 1:7 | C. | 2:11 | D. | 16:25 |
| A. | 该电池工作时,正极反应为2SOCl2+4e-═4Cl-+S+SO2 | |
| B. | 锂电极作该电池负极,负极反应为Li-e-═Li+ | |
| C. | 该电池组装时,必须在无水无氧条件下进行 | |
| D. | 该电池工作时,电子通过外电路从正极流向负极 |
| A. | 标准状况下,11.2 L的甲醇所含的氢原子数大于2NA | |
| B. | 常温下,1mol•L-1的Na2CO3溶液中CO32-的个数必定小于NA | |
| C. | 1mol Cu与含2mol H2SO4,的浓硫酸充分反应,生成的S02的分子个数为NA | |
| D. | 1mol苯分子中含有3NA个碳碳双键 |
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富 | |
| D. | 工业上可以用电解法冶炼铝 |
| X | Y | ||
| Z | W | Q |
| A. | X、W能与钠形成摩尔质量相同的化合物 | |
| B. | 含X和Z元素的常见化合物为分子晶体 | |
| C. | 最高价氧化物对应的水化物酸性:W>Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
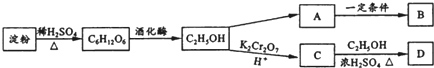
 .
.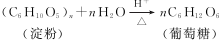 ;
;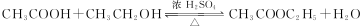
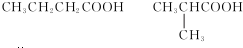 .
.