题目内容
3.下列各组物质中化学键的类型完全相同的是( )| A. | NaCl MgCl2 Na2O | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2SO4 | D. | NH4Cl H2O CO2 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答.
解答 解:A.NaCl、MgCl2、Na2O中金属元素和非金属元素之间只存在离子键,所以化学键类型相同,故A正确;
B.Na2O中金属元素和非金属元素之间只存在离子键,H2O、CO2中不同非金属元素之间只存在共价键,所以化学键类型不同,故B错误;
C.CaCl2中只存在离子键,NaOH中存在离子键和共价键,H2SO4中只存在共价键,所以化学键类型不同,故C错误;
D.NH4Cl中存在离子键和共价键,H2O、CO2中只存在共价键,所以化学键类型不同,故D错误;
故选A.
点评 本题考查了化学键的判断,明确物质的构成微粒及微粒间的作用力是解本题关键,注意:氯化钙中两个氯离子之间不存在化学键、氯化铵是全部由非金属元素组成的离子化合物,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列离子方程式正确的是( )
| A. | 铁与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠跟冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 铜片与稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
11.某溶液能与铝反应生成氢气,则该溶液中一定不能够大量共存的离子组是( )
| A. | NH4+、K+、Ba2+、Cl- | B. | Na+、K+、Cl-、S2- | ||
| C. | Na+、Fe2+、Cl-、NO3- | D. | K+、Na+、SO32-、NO3- |
18.常温下,向20mL 0.5mol•L-1的CH3COOH溶液中逐滴滴加0.5mol•L-1的NaOH溶液,滴定曲线如图.相关分析正确的是( )

| A. | 滴加至①时,c(Na+)=c(CH3COO-),酸碱恰好完全反应 | |
| B. | 滴加至②时,c(OH-)-c(H+)=c(CH3COOH) | |
| C. | 滴定中,$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$逐渐减小 | |
| D. | 滴定中.c(CH3COOH)与c(CH3 C00-)之和保持不变 |
8.下列说法不正确的是( )
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 放热反应不需要加热就能发生 | |
| C. | 吸热反应在一定条件(如常温、加热等)也能发生 | |
| D. | 化学反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对高低 |
15.电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )

| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C | |
| D. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) |
12.下列叙述正确的是( )
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 化学反应中的能量变化与反应物的总能量和生成物的总能量的相对大小无关 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 吸热反应不加热就不会发生 |
13.工业生产苯乙烯是利用乙苯的脱氢反应:
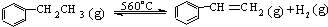 △H>0
△H>0
针对上述反应,有人提出如下观点.其中合理的是( )
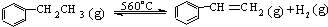 △H>0
△H>0针对上述反应,有人提出如下观点.其中合理的是( )
| A. | 在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率 | |
| B. | 在保持压强一定的条件下,充入不参加反应的气体,有利于提高苯乙烯的产率 | |
| C. | 在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量在不断增大 | |
| D. | 不断分离出苯乙烯可加快反应速率 |