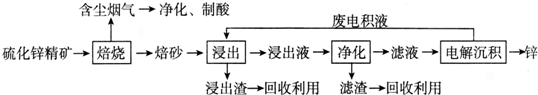
题目内容
11.设NA表示阿伏加德罗常数的值.下列说法中正确的是( )| A. | 5.6 g Fe和一定量的浓HNO3或稀硝酸完全反应,转移电子均为0.3 NA | |
| B. | 16 g氧气或臭氧的氧原子个数均为NA | |
| C. | 1 mol金刚石中含有的C-C键为4NA | |
| D. | 28.6 g Na2CO3•10H2O在晶体中或溶液中,含有的CO32-离子均小于0.1 NA |
分析 A、铁和硝酸反应后最终可能变为+3价,也可能变为+2价;
B、氧气和臭氧均由氧原子构成;
C、1mol金刚石中含2molC-C键;
D、求出28.6gNa2CO3•10H2O晶体的物质的量,然后根据1molNa2CO3•10H2O在晶体中含1mol碳酸根来分析.
解答 解:A、铁和硝酸反应后最终可能变为+3价,也可能变为+2价,故5.6g铁即0.1mol铁转移的电子数可能为0.3NA个,还可能为0.2NA个,故A错误;
B、氧气和臭氧均由氧原子构成,故16g氧气或臭氧中含有的氧原子的物质的量均为1mol,个数均为NA个,故B正确;
C、1mol金刚石中含2molC-C键,即含2NA条,故C错误;
D、28.6gNa2CO3•10H2O晶体的物质的量为0.1mol,而1molNa2CO3•10H2O晶体中含1mol碳酸根,故0.1molNa2CO3•10H2O晶体中含0.1NA个碳酸根;由于在溶液中碳酸根能水解,故当在溶液中时,碳酸根的个数小于0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
1.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电子从②流向①;①③相连时,③为负极;②③相连时,②有气泡逸出;③④相连时,④的质量减少.判断这四种金属活动性由大到小的顺序是( )
| A. | ①③②④ | B. | ③①④② | C. | ④③②① | D. | ④③①② |
6.下列反应:①SO2通入氢硫酸中②SO2通入氯水中③NO2通入水中④Cl2通入溶液中,其中通入的气体只作氧化剂的是( )
| A. | 只有③④ | B. | 只有①② | C. | 只有① | D. | 只有②④ |
3.已知某合金中除铝外,还含有铁、铜中的一种或两种,所含的金属都能通过化学方法检出.请设计合理的实验探究该合金中铁元素的存在.
仅限选择的用品:烧杯、试管、玻璃棒、量筒、容量瓶、胶头滴管、药匙、稀硫酸、稀硝酸、20%KSCN溶液、NaOH溶液.已知稀硝酸具有强氧化性,能将Fe氧化为Fe3+
完成以下实验探究过程:
(1)提出假设
猜想1:该合金中除铝外,还含有铁(填名称,下同).
猜想2:该合金中除铝外,还含有铜.
猜想3:该该合金中除铝外,还含有铁、铜.
(2)设计实验方案.基于猜想3设计出实验方案
(3)实验过程.根据(2)的实验方案,补充下表中的实验操作、预期现象和结论.
探究结论.猜想3成立(填″猜想1″″猜想2″或″猜想3″).
仅限选择的用品:烧杯、试管、玻璃棒、量筒、容量瓶、胶头滴管、药匙、稀硫酸、稀硝酸、20%KSCN溶液、NaOH溶液.已知稀硝酸具有强氧化性,能将Fe氧化为Fe3+
完成以下实验探究过程:
(1)提出假设
猜想1:该合金中除铝外,还含有铁(填名称,下同).
猜想2:该合金中除铝外,还含有铜.
猜想3:该该合金中除铝外,还含有铁、铜.
(2)设计实验方案.基于猜想3设计出实验方案
(3)实验过程.根据(2)的实验方案,补充下表中的实验操作、预期现象和结论.
| 步骤 | 实验方案 | 预期现象和结论 |
| ① | 用药匙取少许样品粉末,加入试管A中,再用胶头滴管取过量的NaOH溶液加入试管A中,充分反应后,静置.弃去上层清液,剩余固体备用. | 粉末部分溶解,并有气体放出,则合金中一定含有铝 |
| ② | 向试管A的剩余固体中加入过量的稀硫酸充分反应后,静置,取上层清液于试管B中,剩余固体备用. | 固体部分溶解,并有气体放出,溶液呈浅绿色,则合金中可能含有 铁. |
| ③ | 在试管B中加入少许稀硝酸,再滴加KSCN溶液 | 溶液先变成黄色,加KSCN后显血红色,结合②可知,一定含铁 |
| ④ | 往②剩余固体中加入稀硝酸,再滴加NaOH溶液 | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有蓝色沉淀产生,则合金中一定含有铜. |
16.下列反应既是氧化还原,又是吸热反应的是( )
| A. | 镁条与稀H2SO4反应 | |
| B. | 乙醇在氧气中的燃烧反应 | |
| C. | Ba(OH)2•8H2O与NH4Cl | |
| D. | 炽热的焦炭和水蒸气反应制取水煤气 |
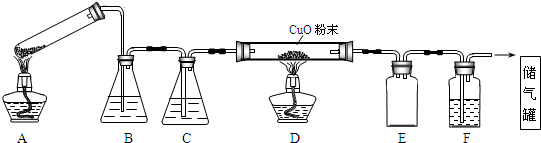
 已知二氧化硫可使高锰酸钾溶液褪色反应的化学方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
已知二氧化硫可使高锰酸钾溶液褪色反应的化学方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4