题目内容
1.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电子从②流向①;①③相连时,③为负极;②③相连时,②有气泡逸出;③④相连时,④的质量减少.判断这四种金属活动性由大到小的顺序是( )| A. | ①③②④ | B. | ③①④② | C. | ④③②① | D. | ④③①② |
分析 在原电池反应中,负极金属较为活泼,电子从负极经外电路流向正极,一般来说,气体、金属在正极上析出,负极质量减小,以此解答该题.
解答 解:①②相连时,外电路电子从②流向①,说明②为负极,①为正极,活泼性②>①;
①③相连时,③为负极,负极金属比正极活泼,则活泼性③>①;
②③相连时,②有气泡逸出,说明③为负极,则活泼性③>②;
③④相连时,④的质量减少,说明④为负极,③为正极,活泼性④>③,
所以这四种金属活动性由大到小的顺序是④③②①,
故选C.
点评 本题考查金属活动性的比较,题目难度不大,注意根据反应现象和电流判断电源的正负极,负极金属较活泼.

练习册系列答案
相关题目
9.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O$?_{充电}^{放电}$Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
| A. | 放电时负极得电子,质量减轻 | |
| B. | 放电时电解质溶液中的OH-向正极移动 | |
| C. | 充电时阴极附近溶液的pH减小 | |
| D. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O |
16.H2和 I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ/mol.已知:

(a、b、c 均大于零).下列说法正确的是( )

(a、b、c 均大于零).下列说法正确的是( )
| A. | H2、I2和 HI 分子中的化学键都是非极性共价键 | |
| B. | 断开 2 mol HI 分子中的化学键所需能量约为(c+b+a) kJ | |
| C. | 相同条件下,1 mol H2(g)和 1mol I2(g)总能量小于 2 mol HI (g)的总能量 | |
| D. | 向密闭容器中加入 2 mol H2(g)和 2 mol I2(g),充分反应后放出的热量为 2a kJ |
10.下列有关金属的用途,其中利用的是金属的化学性质的是( )
| A. | 铜--电线 | B. | 铝--反射镜 | ||
| C. | 铁--回收溶液中的银 | D. | 不锈钢--炊具 |
11.设NA表示阿伏加德罗常数的值.下列说法中正确的是( )
| A. | 5.6 g Fe和一定量的浓HNO3或稀硝酸完全反应,转移电子均为0.3 NA | |
| B. | 16 g氧气或臭氧的氧原子个数均为NA | |
| C. | 1 mol金刚石中含有的C-C键为4NA | |
| D. | 28.6 g Na2CO3•10H2O在晶体中或溶液中,含有的CO32-离子均小于0.1 NA |
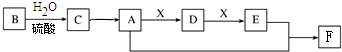
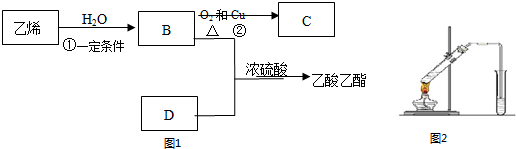
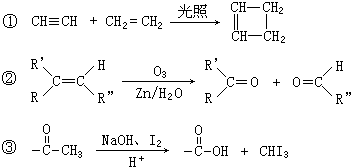
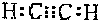 .
.
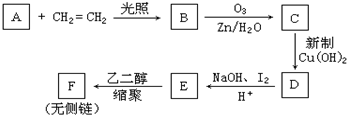
 ,CCH3COCH2CH2CHO,DCH3COCH2CH2COOH,F
,CCH3COCH2CH2CHO,DCH3COCH2CH2COOH,F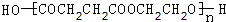 .
.