题目内容
4.下表列出了A~R 10种元素在周期表中的位置,用元素符号或化学式填空.
(1)这十种元素中:化学性质最不活泼元素的原子结构示意图是
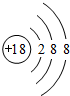 ,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是
,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是 ,最高价氧化物的水化物酸性最强的酸的化学式是HClO4;
,最高价氧化物的水化物酸性最强的酸的化学式是HClO4;(2)A、D元素的最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O;
(3)A、D、F三种元素的简单离子半径由大到小的顺序为O2->Na+>Al3+;
(4)H元素跟A元素形成的化合物的焰色反应呈黄色;
(5)用电子式表示C和G两种元素形成化合物的过程
 .
.
分析 由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、E为碳、F为氧、I为氟、G为Cl、H为Br、R为Ar.
(1)稀有气体Ar化学性质最不活泼;同周期自左而右非金属性增强、同主族自上而下非金属性减弱;上述元素中K的金属性最强,故KOH的碱性最强,由钾离子与氢氧根离子构成;最高价氧化物的水化物酸性最强的酸为高氯酸;
(2)A、D元素的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(3)Na+、Al3+、O2-离子电子层结构相同,核电荷数越大离子半径越小;
(4)H元素跟A元素形成的化合物为NaBr,含有钠元素,焰色反应呈黄色;
(5)C和G两种元素形成化合物为MgCl2,由镁离子与氯离子构成,用电子式表示形成过程,左侧为原子电子式,右侧为相应物质的电子式,中间用→连接.
解答 解:由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、E为碳、F为氧、I为氟、G为Cl、H为Br、R为Ar.
(1)稀有气体Ar化学性质最不活泼,其原子结构示意图为 ;同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故上述元素中F元素非金属性最强;上述元素中K的金属性最强,故KOH的碱性最强,由钾离子与氢氧根离子构成,电子式为
;同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故上述元素中F元素非金属性最强;上述元素中K的金属性最强,故KOH的碱性最强,由钾离子与氢氧根离子构成,电子式为 ;最高价氧化物的水化物酸性最强的酸为HClO4;
;最高价氧化物的水化物酸性最强的酸为HClO4;
故答案为: ;F;
;F; ;HClO4;
;HClO4;
(2)A、D元素的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)Na+、Al3+、O2-离子电子层结构相同,核电荷数越大离子半径越小,离子半径由大到小的顺序为O2->Na+>Al3+,故答案为:O2->Na+>Al3+;
(4)H元素跟A元素形成的化合物为NaBr,含有钠元素,焰色反应呈黄色,故答案为:黄;
(5)C和G两种元素形成化合物为MgCl2,由镁离子与氯离子构成,用电子式表示形成过程为 ,
,
故答案为: .
.
点评 本题考查元素周期表与元素周期律,难度不大,注意对元素周期律的理解掌握,注意用电子式表示物质或化学键的形成过程.

| W | X | Y | ||
| R | Z |
 .
.(2)W与氢原子形成6原子分子的结构简式CH2=CH2.
(3)超细RX粉末被应用于大规模集成电路领域.其制作原理为R2Y3、X2、W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1;其反应的化学方程式为Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(5)火箭发动机的燃料胼(N2H4)与氧化剂N2O4反应生成N2和水蒸气.
已知①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4 kJ/mol.
(6)温度为T时,向2.0L恒容密闭容器中充入1.00mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡.反应过程中测定的部分数据见表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | NO遇到空气变为红棕色 | |
| B. | NaCl溶液高温灼烧后呈现黄色 | |
| C. | SO2 通入到品红溶液中中使其褪色 | |
| D. | 含有色素的溶液加入活性炭后颜色褪去 |
| A. | 若X为非气态,则正反应为放热反应 | |
| B. | 若正反应为放热反应,则X为气态 | |
| C. | 在平衡混合物中加入少量Z(s),则平衡向左移动 | |
| D. | 压强变化对该平衡没有影响 |
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | 工业固氮N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知;人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较p1、p2的大小关系р2>р1.

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ.mol-1,2H2(g)+O2(g)?2H2O(l) H=-571.6kJ.mol-1)

