题目内容
16.在固定容积的密闭容器中,反应2X?Y(g)+Z(s)已达到平衡,此时升高温度则气体混合物的密度增大,下列叙述正确的是( )| A. | 若X为非气态,则正反应为放热反应 | |
| B. | 若正反应为放热反应,则X为气态 | |
| C. | 在平衡混合物中加入少量Z(s),则平衡向左移动 | |
| D. | 压强变化对该平衡没有影响 |
分析 达到化学平衡后,升高温度,容器内气体的密度增大,说明气体的质量增大,若平衡向正反应方向移动,则X应为非气态,若平衡向逆反应方向移动,则X应为气态,
A、升高温度,气体的质量增大,气体的密度才增加,据此回答;
B.若正反应为放热反应,升高温度平衡向逆反应移动,气体的质量增大,据此判断X的状态;
C、固体量的增减不会引起平衡的移动;
D.压强对于化学反应前后气体物质的量变化的反应有影响.
解答 解:达到化学平衡后,升高温度,容器内气体的密度增大,说明气体的质量增大,若平衡向正反应方向移动,则X应为非气态,若平衡向逆反应方向移动,则X应为气态,
A、X为非气态,反应中只有Y为气体,升高温度,Y的质量增大,平衡应向正反应移动,故正反应为吸热反应,故A错误;
B.若正反应是放热反应,升高温度平衡向逆反应方向移动,容器内气体的密度增大,说明气体的质量增大,则X应为气态才能符合,故B正确;
C.在平衡混合物中加入少量Z(s),则平衡不会移动,故C错误;
D.反应中存在气体,所以压强变化会影响平衡的移动,故D错误;
故选B.
点评 本题考查化学平衡的影响因素,题目难度中等,明确容器内气体密度的变化、气体质量的变化是关键.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
7.在下列各指定溶液中,离子可能大量共存的是( )
| A. | 澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- | |
| B. | 使红色石蕊试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
11.下列化学反应中,不属于氧化还原反应( )
| A. | 2H2O2 $\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | B. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | Cl2+H2O═HCl+HClO |
8. 资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.
资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.
(1)兴趣小组同学认为,上述反应的生成物可能与反应温度(T),KOH溶液的浓度(c)有关.他们做了如下对比实验(每次实验中硫粉的质量、KOH溶液的体积均相同).
实验①~④是探究温度对生成物的影响,⑤~⑧是探究KOH溶液的浓度对生成物的影响.请在表中相应空格内填人相应数据.
(2)兴趣小组设计实验对上述反应中生成的盐的成分进行探究.他们提出如下假设,请你根据
氧化还原反应的规律,L完成假设二和假设三:
假设一:生成的盐是K2S和K2S03;
假设二:生成的盐是K2S和K2S04;
假设三:生成的盐是K2S、K2S03和K2S04的混合物;
(3)请你设计实验验证上述假设一.完成下表中内容.[除了硫粉与热的KOH溶液的反应液之外,可供选择的药品有稀硝酸,稀盐酸等;已知:6H++SO32-+2S2-=3S+3H2O]
(4)兴趣小组通过改变硫粉的质量,得出生成钾盐的质量与硫粉质量的变化关系如图所示.有人据此得出结论:生成的盐一定是K2S和K2SO3的混合物.请你根据计算结果指出该结论是否正确不正确;3.2g硫完全反应,不管生成硫化钾和亚硫酸钾的混合物、硫化钾和硫酸钾的混合物还是硫化钾、亚硫酸钾和硫酸钾的混合物,其质量都是12.6g.
(5)请分析上述反应中有K2S04生成的可能原因是亚硫酸钾具有还原性,很容易被氧气氧化为硫酸钾.
 资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.
资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.(1)兴趣小组同学认为,上述反应的生成物可能与反应温度(T),KOH溶液的浓度(c)有关.他们做了如下对比实验(每次实验中硫粉的质量、KOH溶液的体积均相同).
实验①~④是探究温度对生成物的影响,⑤~⑧是探究KOH溶液的浓度对生成物的影响.请在表中相应空格内填人相应数据.
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| T/℃ | 50 | 60 | 70 | 80 | 90 |
| c/mol.L-1 | 1.0 | 3.0 |
氧化还原反应的规律,L完成假设二和假设三:
假设一:生成的盐是K2S和K2S03;
假设二:生成的盐是K2S和K2S04;
假设三:生成的盐是K2S、K2S03和K2S04的混合物;
(3)请你设计实验验证上述假设一.完成下表中内容.[除了硫粉与热的KOH溶液的反应液之外,可供选择的药品有稀硝酸,稀盐酸等;已知:6H++SO32-+2S2-=3S+3H2O]
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
(5)请分析上述反应中有K2S04生成的可能原因是亚硫酸钾具有还原性,很容易被氧气氧化为硫酸钾.
5.下列有关物质的性质和应用正确的是( )
| A. | 福尔马林可用于保存海鲜产品 | |
| B. | 油脂在酸性条件下可水解生成高级脂肪酸和甘油 | |
| C. | 淀粉、油脂、氨基酸都能水解,但水解产物不同 | |
| D. | 合成橡胶与光导纤维都属于有机高分子材料 |
6.下列说法正确的是( )
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使酸性KMnO4溶液褪色 | |
| D. | “可燃冰”主要成分是甲烷和水 |

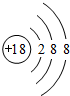 ,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是
,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是 ,最高价氧化物的水化物酸性最强的酸的化学式是HClO4;
,最高价氧化物的水化物酸性最强的酸的化学式是HClO4; .
.