题目内容
19.下列反应中,不属于化学反应的是( )| A. | NO遇到空气变为红棕色 | |
| B. | NaCl溶液高温灼烧后呈现黄色 | |
| C. | SO2 通入到品红溶液中中使其褪色 | |
| D. | 含有色素的溶液加入活性炭后颜色褪去 |
分析 A、一氧化氮可以和氧气之间反应生成二氧化氮;
B、焰色反应属于物理变化;
C、SO2 通入到品红溶液中中使其褪色,发生了化合反应;
D、活性炭具有吸附性,能除色味.
解答 解:A、无色的一氧化氮可以和氧气之间反应生成红棕色的气体二氧化氮,与化学反应有关,故A错误;
B、NaCl溶液高温灼烧后呈现黄色,焰色反应属于物理变化,故B正确;
C、SO2 通入到品红溶液中中使其褪色,发生了化合反应,故C错误;
D、红墨水中投入活性碳,红色褪去,是因为活性炭具有吸附性,能除色味,属于物理变化,故D正确.
故选BD.
点评 本题考查学生物质的性质知识,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
9.化学与生活密切相关.下列应用中利用了物质氧化性的是( )
| A. | 漂白粉漂白织物 | B. | 纯碱去油污 | C. | 食醋除水垢 | D. | 明矾净化水 |
10.强酸与强碱稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.向1L 0.5 mol•L-1的NaOH溶液中加入下列物质:①浓硫酸 ②稀硝酸,恰好完全反应的热效应依次为△H1、△H2,则二者的关系正确的是( )
| A. | △H1=△H2 | B. | △H1>△H2 | C. | △H2>△H1 | D. | 无法比较 |
7.在下列各指定溶液中,离子可能大量共存的是( )
| A. | 澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- | |
| B. | 使红色石蕊试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
14.下列变化一定会影响化学平衡的是( )
| A. | 浓度 | B. | 催化剂 | C. | 压强 | D. | 温度 |
11.下列化学反应中,不属于氧化还原反应( )
| A. | 2H2O2 $\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | B. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | Cl2+H2O═HCl+HClO |
8. 资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.
资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.
(1)兴趣小组同学认为,上述反应的生成物可能与反应温度(T),KOH溶液的浓度(c)有关.他们做了如下对比实验(每次实验中硫粉的质量、KOH溶液的体积均相同).
实验①~④是探究温度对生成物的影响,⑤~⑧是探究KOH溶液的浓度对生成物的影响.请在表中相应空格内填人相应数据.
(2)兴趣小组设计实验对上述反应中生成的盐的成分进行探究.他们提出如下假设,请你根据
氧化还原反应的规律,L完成假设二和假设三:
假设一:生成的盐是K2S和K2S03;
假设二:生成的盐是K2S和K2S04;
假设三:生成的盐是K2S、K2S03和K2S04的混合物;
(3)请你设计实验验证上述假设一.完成下表中内容.[除了硫粉与热的KOH溶液的反应液之外,可供选择的药品有稀硝酸,稀盐酸等;已知:6H++SO32-+2S2-=3S+3H2O]
(4)兴趣小组通过改变硫粉的质量,得出生成钾盐的质量与硫粉质量的变化关系如图所示.有人据此得出结论:生成的盐一定是K2S和K2SO3的混合物.请你根据计算结果指出该结论是否正确不正确;3.2g硫完全反应,不管生成硫化钾和亚硫酸钾的混合物、硫化钾和硫酸钾的混合物还是硫化钾、亚硫酸钾和硫酸钾的混合物,其质量都是12.6g.
(5)请分析上述反应中有K2S04生成的可能原因是亚硫酸钾具有还原性,很容易被氧气氧化为硫酸钾.
 资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.
资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.(1)兴趣小组同学认为,上述反应的生成物可能与反应温度(T),KOH溶液的浓度(c)有关.他们做了如下对比实验(每次实验中硫粉的质量、KOH溶液的体积均相同).
实验①~④是探究温度对生成物的影响,⑤~⑧是探究KOH溶液的浓度对生成物的影响.请在表中相应空格内填人相应数据.
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| T/℃ | 50 | 60 | 70 | 80 | 90 |
| c/mol.L-1 | 1.0 | 3.0 |
氧化还原反应的规律,L完成假设二和假设三:
假设一:生成的盐是K2S和K2S03;
假设二:生成的盐是K2S和K2S04;
假设三:生成的盐是K2S、K2S03和K2S04的混合物;
(3)请你设计实验验证上述假设一.完成下表中内容.[除了硫粉与热的KOH溶液的反应液之外,可供选择的药品有稀硝酸,稀盐酸等;已知:6H++SO32-+2S2-=3S+3H2O]
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
(5)请分析上述反应中有K2S04生成的可能原因是亚硫酸钾具有还原性,很容易被氧气氧化为硫酸钾.

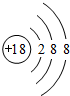 ,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是
,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是 ,最高价氧化物的水化物酸性最强的酸的化学式是HClO4;
,最高价氧化物的水化物酸性最强的酸的化学式是HClO4; .
.