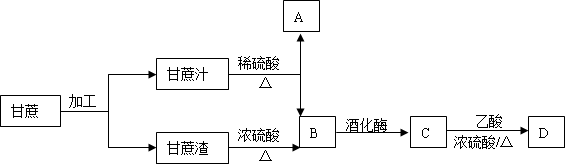
题目内容
3.铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3.
请回答下列问题:
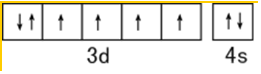
(1)C、N、O的电负性由大到小的顺序为O>N>C,基态Fe原子的价电子排布图为
 .
.(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是分子晶体,与CO互为等电子体的分子的电子式为
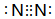 .
.(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是sp3、sp2,配体中提供孤对电子的原子是N.
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有bd形成.
a.离子键 b.配位键 c.非极性键 d.δ键
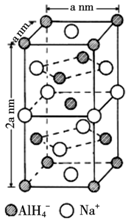
(5)NaAlH4晶体的晶胞如图,
与Na+紧邻且等距的AlH4-有8个;NaAlH4晶体的密度为$\frac{108×1{0}^{21}}{{a}^{3}{N}_{A}}$g•cm-3(用含a的代数式表示).
分析 (1)同一周期元素,元素电负性随着原子序数增大而增大;Fe原子核外有26个电子,其3d、4s能级上的电子为其价电子;
(2)分子晶体熔沸点较低;等电子体的原子个数相等、价电子数相等;
(3)该配合物中C原子价层电子对个数是4和3且不含孤电子对,根据价层电子对互斥理论确定C原子杂化方式;该配体中Cu原子提供空轨道、N原子提供孤电子对;
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有配位键和δ键生成;
(5)以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,根据均摊法可知,晶胞中AlH4-数目为1+8×$\frac{1}{8}$+4×$\frac{1}{2}$=4,Na+数目为6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,则二者配位数相等;
结合晶胞中AlH4-、Na+数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算密度.
解答 解:(1)同一周期元素,元素电负性随着原子序数增大而增大,这三种元素第一电离能大小顺序是O>N>C;Fe原子3d、4s能级电子为其价电子,基态Fe原子的价电子排布图为 ,
,
故答案为:O>N>C; ;
;
(2)熔沸点较低的晶体为分子晶体,Fe(CO)5又名羰基铁,常温下为黄色油状液体,其熔沸点较低,为分子晶体;与CO互为等电子体的分子是氮气分子,电子式为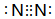 ,
,
故答案为:分子晶体;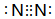 ;
;
(3)该配合物中C原子价层电子对个数是4和3且不含孤电子对,根据价层电子对互斥理论确定C原子杂化方式为sp3、sp2,该配体中Cu原子提供空轨道、N原子提供孤电子对,
故答案为:sp3、sp2;N;
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有Cu原子和N、C原子之间的配位键且也是δ键生成,
故选bd;
(5)根据均摊法可知,晶胞中AlH4-数目为1+8×$\frac{1}{8}$+4×$\frac{1}{2}$=4,Na+数目为6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,则二者配位数为1:1,以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,则与Na+紧邻且等距的AlH4-有8个;
晶胞质量为4×$\frac{54}{{N}_{A}}$g,晶胞密度为4×$\frac{54}{{N}_{A}}$g÷[(a×10-7 cm)2×2a×10-7 cm]=$\frac{108×1{0}^{21}}{{a}^{3}{N}_{A}}$g•cm-3,
故答案为:8;$\frac{108×1{0}^{21}}{{a}^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、元素周期律、原子核外电子排布等知识点,侧重考查学生分析、判断、计算及空间想象能力,难点是晶胞计算及配位数确定,题目难点中等.

| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡时吸收的热量 | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.5 | Q1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | Q2 |
| A. | T1<T2 | |
| B. | Q1>Q2 | |
| C. | 甲容器中,混合气体的密度始终保持不变 | |
| D. | 乙容器中,反应进行到1.5min时,n(H2O)=1.4mol |
①胆矾晶体在空气中失水风化
②导电
③燃烧
④煤的干馏
⑤白磷转变成红磷
⑥工业制氧气
⑦久置氯水变成无色
⑧分馏
⑨NO2气体冷却后颜色变浅
⑩氢氧化铁胶体加入硫酸钠有沉淀生成.
| A. | ①②③④⑦ | B. | ③④⑤⑦⑩ | C. | ①③④⑤⑦⑨ | D. | ①③④⑦⑩ |
| A. | 2.0gH218O与D216O的混合物中所含中子数为NA | |
| B. | 0.1molCl2溶于足量水中,转移的电子数为0.1NA | |
| C. | 常温常压下50g 46%的乙醇溶液中,所含氧原子数目为0.5NA | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
| A. | NaCl的电子式: | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | CO2的分子模型示意图: | D. | O2-的离子结构示意图: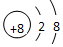 |

| A. | 40℃时,将35 g NaCl溶于100 g水中,降温至0℃时,可析出晶体 | |
| B. | 20℃饱和KNO3溶液的溶质质量分数>31.6% | |
| C. | a点KNO3和NaCl溶液的物质的量浓度相等 | |
| D. | 固体KNO3中混有NaCl,可用重结晶进行提纯 |
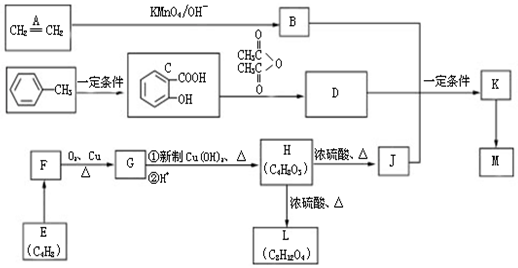

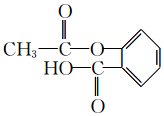 .
.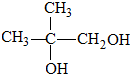 ,H→J的反应类型消去反应.
,H→J的反应类型消去反应. .
.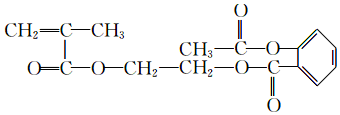 .
. .
. 或
或 或
或 .
.
 .
.