题目内容
13.甘蔗是我们生活中较为常见的经济作物.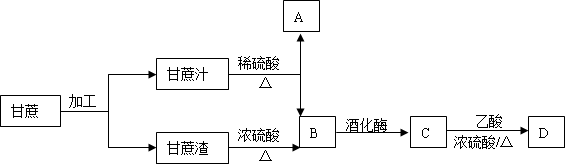
(1)B的分子式是C6H12O6.
(2)向试管中加入甘蔗渣经浓硫酸水解后的混合液,先加NaOH溶液,再加新制氢氧化铜,加热,可看到砖红色沉淀(现象).
(3)写出C→D的化学方程式CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
分析 甘蔗的主要成分是蔗糖,蔗糖水解生成葡萄糖和果糖,葡萄糖在酒化酶作用下反应生成C为CH3CH2OH,则A是果糖、B是葡萄糖,乙醇和乙酸在浓硫酸作催化剂条件下发生酯化反应生成D为 CH3COOCH2CH3,结合题目分析解答.
解答 解:甘蔗的主要成分是蔗糖,蔗糖水解生成葡萄糖和果糖,葡萄糖在酒化酶作用下反应生成C为CH3CH2OH,则A是果糖、B是葡萄糖,乙醇和乙酸在浓硫酸作催化剂条件下发生酯化反应生成D为 CH3COOCH2CH3,
(1)通过以上分析知,B为葡萄糖,其分子式为C6H12O6,故答案为:C6H12O6;
(2)蔗糖水解生成葡萄糖,葡萄糖在碱性条件下和新制氢氧化铜悬浊液反应生成砖红色沉淀氧化亚铜,所以看到的现象是有砖红色沉淀生成,故答案为:砖红色沉淀;
(3)C是乙醇,乙醇和乙酸在浓硫酸作催化剂、加热条件下发生酯化反应生成乙酸乙酯,反应方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确有机物官能团及其性质关系、物质之间的转化是解本题关键,注意醛和新制氢氧化铜悬浊液反应时必须在碱性条件下,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.化合物FeO具有NaCl型结构.在天然样品中,往往由于部分Fe2+被Fe3+代替,晶体存在缺陷,使n(Fe):n(O)<1.用Fe2+和Fe3+可以将组成为Fe0.95O的某天然FeO样品表示为( )
| A. | Fe2+0.45Fe3+0.50O | B. | Fe2+0.85Fe 3+0.10O | ||
| C. | Fe2+0.15Fe3+0.80O | D. | Fe2+0.20Fe 3+0.75O |
1.近年来美国研究人员合成了光伏电池新型硅材料--Si24(如图所示).下列相关说法正确的是( )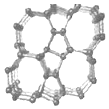

| A. | Si24是一种新型化合物 | |
| B. | Si24是硅的一种同素异形体 | |
| C. | Si24易与稀硫酸反应生成氢气 | |
| D. | 硅太阳能电池供电原理与原电池相同 |
8.下列说法正确的是( )
| A. | H2O与D2O互为同位素 | B. | 纤维素与淀粉互为同分异构体 | ||
| C. | 干冰和冰为同一种物质 | D. | 甲烷和十六烷互为同系物 |
18.某稀硫酸和稀硝酸的混合溶液中c(SO42-)+c(NO3-)=2.5mol•L-1,取200mL该混合酸,则能溶解铜的最大质量为( )
| A. | 12.8 g | B. | 19.2 g | C. | 32.0 g | D. | 38.4 g |
14.设反应①Fe(s)+CO2(g)═FeO(s)+CO(g) 平衡常数为 K1;
反应②Fe(s)+H2O(g)═FeO(s)+H 2 (g) 平衡常数为 K2;
测得在不同温度下,K1、K2值如下:
(1)在500℃时进行反应①,若CO2起始浓度为1mol•L-1,10分钟后达到平衡,则V(CO)为0.05mol/(L•min).
(2)在 900℃时反应 CO2(g)+H2(g)═CO(g)+H2O(g)的平衡常数 K=1.50.
(3)700℃反应②达到平衡,其它条件不变时,使得该平衡向右移动,可以采取的措施有BC(选填编号).
A.缩小反应器体积 B.加入水蒸气
C.降低温度到500℃D.加入Fe粉
(4)如果上述反应①在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是AC(选填编号).
A.v正(CO)=v 逆 (CO2) B.C(CO)=C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
(5)若反应①在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后,相应物质的物理量如何变化?(选填“增大”、“减小”或“不变”)
①降低温度,CO2的平衡浓度增大;
②再通入CO2,CO2的转化率不变.
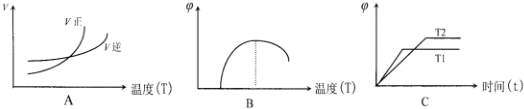
(6)下列图象符合反应①的是A(填序号)(图中 v 是速率、φ 为混合其中CO含量,T为温度)
反应②Fe(s)+H2O(g)═FeO(s)+H 2 (g) 平衡常数为 K2;
测得在不同温度下,K1、K2值如下:
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
(2)在 900℃时反应 CO2(g)+H2(g)═CO(g)+H2O(g)的平衡常数 K=1.50.
(3)700℃反应②达到平衡,其它条件不变时,使得该平衡向右移动,可以采取的措施有BC(选填编号).
A.缩小反应器体积 B.加入水蒸气
C.降低温度到500℃D.加入Fe粉
(4)如果上述反应①在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是AC(选填编号).
A.v正(CO)=v 逆 (CO2) B.C(CO)=C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
(5)若反应①在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后,相应物质的物理量如何变化?(选填“增大”、“减小”或“不变”)
①降低温度,CO2的平衡浓度增大;
②再通入CO2,CO2的转化率不变.
(6)下列图象符合反应①的是A(填序号)(图中 v 是速率、φ 为混合其中CO含量,T为温度)

 .
.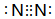 .
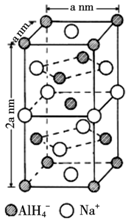
.
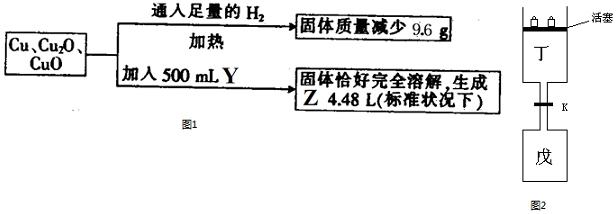
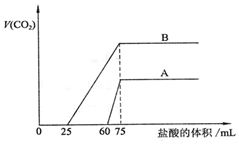 取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸体积之间的关系如图所示,试回答下列问题: