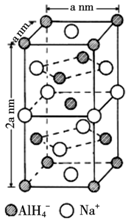
题目内容
12.氧化还原反应在生产生活中有着重要的应用.请按要求写出相应的方程式.(1)将含SO2的废气通入含Fe2+(催化剂)的溶液中,常温下可使SO2转化为SO24-,其总反应为2SO2+O2+2H2O=2H2SO4.上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式:2Fe3++SO2+2H2O=2Fe2++SO4 2-+4H+.
(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液.若溶液的pH偏高,则碱式硫酸铝产率降低且有气泡产生,用化学方程式表示其原因:3CaCO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CaSO4↓+3CO2↑.
(3)ClO2是一种高效安全的杀菌消毒剂.氯化钠电解法生产ClO2工艺原理示意图如下:

①写出氯化钠电解槽内发生反应的离子方程式:Cl-+3H2O$\frac{\underline{\;电解\;}}{\;}$ClO3-+3H2↑.
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目:
 .
.③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,自身被还原成Cl-.写出该反应的离子方程式2ClO2+2CN-=2CO2↑+2Cl-+N2↑.
分析 (1)根据题中反应原理,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,第二步是铁离子将二氧化硫氧化成硫酸根离子,根据电荷守恒和元素守恒可书写反应的离子方程式;
(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,若溶液的pH偏高,溶液碱性增强,铝离子与碳酸根离子双水解生成氢氧化铝和二氧化碳,根据元素守恒可书写反应的化学方程式;
(3)根据流程图可知道:食盐水在特定条件下电解得到氯酸钠(NaClO3),NaClO3和HCl反应,生成ClO2,可以写出方程式,并用化合价升降法配平得到,ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,应为二氧化碳和氮气,自身被还原成Cl-,根据电荷守恒和元素守恒写出该反应的离子方程式;
解答 解:(1)根据题中反应原理,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,第二步是铁离子将二氧化硫氧化成硫酸根离子,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO4 2-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO4 2-+4H+;
(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,若溶液的pH偏高,溶液碱性增强,铝离子与碳酸根离子双水解生成氢氧化铝和二氧化碳,反应的化学方程式为3CaCO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CaSO4↓+3CO2↑,
故答案为:3CaCO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CaSO4↓+3CO2↑;
(3)根据流程图可知道:食盐水在特定条件下电解得到氯酸钠(NaClO3),NaClO3和HCl反应,生成ClO2,可以写出方程式,并用化合价升降法配平得到,ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,应为二氧化碳和氮气,自身被还原成Cl-,根据电荷守恒和元素守恒写出该反应的离子方程式,
①电解食盐水得到氯酸钠(NaClO3)和H2,电解的离子反应方程式为:Cl-+3H2O$\frac{\underline{\;电解\;}}{\;}$ClO3-+3H2↑,故答案为:Cl-+3H2O$\frac{\underline{\;电解\;}}{\;}$ClO3-+3H2↑;
②ClO2发生器中的反应为,化学方程式NaClO3和盐酸发生歧化反应,生成NaCl、ClO2、Cl2、H2O,用化学方程式表示并标出电子转移的方向及数目为 ,
,
故答案为: ;
;
③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,应为二氧化碳和氮气,自身被还原成Cl-,反应的离子方程式为 2ClO2+2CN-=2CO2↑+2Cl-+N2↑,
故答案为:2ClO2+2CN-=2CO2↑+2Cl-+N2↑.
点评 本题通过化学工艺流程,考查了氧化还原反应相关概念、配平及计算,电解原理,综合性强,题目难度中等,对于该类题目的处理,注意看清工艺流程的目的,分析工艺流程的过程,寻找与所学知识的结合点.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案| A. | 实验过程中使用四氯化碳时戴防尘口罩 | |
| B. | 实验过程中移取强酸、强碱溶液应带防酸碱手套 | |
| C. | 实验场所严禁携带食物;禁止用饮料瓶装化学药品,防止误食 | |
| D. | 称取粉末状的有毒药品时,要带口罩防止吸入 |
 某有机物结构式如图所示,其一氯代物共有(不考虑立体异构)( )
某有机物结构式如图所示,其一氯代物共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 7种 |
| A. | 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | |
| B. | 向某溶液中滴加硝酸酸化的BaCl2溶液产生白色沉淀,则该溶液中含有SO42- | |
| C. | 在电解精炼铜过程中,阳极质量的减少多于阴极质量的增加 | |
| D. | 298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其△H<0 |
 将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急.
将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急.(1)根据键能数据估算CH4+4F2=CF4+4HF的反应热△H=-1940kJ•mol-1.
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:CH3OCH3+6CO${\;}_{3}^{2-}$-12e-=8CO2+3H2O.写出该燃料电池的正极反应式:O2+4e-+2CO2=2CO32-.
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2.某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式为Co2+-e-=Co3+.
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生的H2S废气.
①电解池中电极A、B均为惰性电极,其中A为电解池的B极;电极B所得到的物质X的分子式为H2.
②反应池中发生的离子反应方程式为H2S+2Fe3+=2Fe2++S↓+2H+.
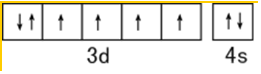
| A. | Fe2+0.45Fe3+0.50O | B. | Fe2+0.85Fe 3+0.10O | ||
| C. | Fe2+0.15Fe3+0.80O | D. | Fe2+0.20Fe 3+0.75O |
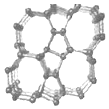
| A. | Si24是一种新型化合物 | |
| B. | Si24是硅的一种同素异形体 | |
| C. | Si24易与稀硫酸反应生成氢气 | |
| D. | 硅太阳能电池供电原理与原电池相同 |
反应②Fe(s)+H2O(g)═FeO(s)+H 2 (g) 平衡常数为 K2;
测得在不同温度下,K1、K2值如下:
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
(2)在 900℃时反应 CO2(g)+H2(g)═CO(g)+H2O(g)的平衡常数 K=1.50.
(3)700℃反应②达到平衡,其它条件不变时,使得该平衡向右移动,可以采取的措施有BC(选填编号).
A.缩小反应器体积 B.加入水蒸气
C.降低温度到500℃D.加入Fe粉
(4)如果上述反应①在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是AC(选填编号).
A.v正(CO)=v 逆 (CO2) B.C(CO)=C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
(5)若反应①在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后,相应物质的物理量如何变化?(选填“增大”、“减小”或“不变”)
①降低温度,CO2的平衡浓度增大;
②再通入CO2,CO2的转化率不变.
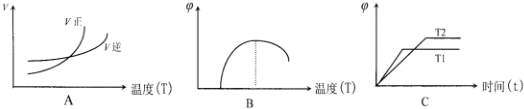
(6)下列图象符合反应①的是A(填序号)(图中 v 是速率、φ 为混合其中CO含量,T为温度)
 .
. .
.