题目内容
14.某同学为了检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,选用了如图所示实验装置.
(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)①中无水硫酸铜的作用是检验反应生成的水蒸气.
(3)②中酸性KMnO4溶液的作用是除去混合气体中的SO2.
(4)②中两次用到品红溶液,品红溶液A的作用是检验生成的SO2气体.品红溶液B的作用是验SO2是否除尽.
(5)③中出现的现象是出现白色沉淀,
(6)盛酸性高锰酸钾溶液的洗气瓶中发生反应的离子方程式是5SO2+MnO4-+2H2O=2Mn2++5SO42-+4H+.
分析 木炭粉与浓硫酸反应化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,用无水硫酸铜检验水蒸气,用品红溶液检验二氧化硫,用澄清石灰水检验二氧化碳,由于二氧化硫与澄清石灰水也产生白色沉淀,故检验二氧化碳前需要除去二氧化硫,品红溶液A检验SO2,通过酸性高锰酸钾溶液除去SO2,品红溶液B检验二氧化硫除尽,品红溶液B不褪色,澄清石灰水变浑浊,说明生成二氧化碳.
解答 解:(1)木炭粉与浓硫酸反应化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(2)实验利用白色硫酸铜遇到水变为蓝色证明含有水蒸气,①中无水硫酸铜的作用是:检验反应生成的水蒸气,
故答案为:检验反应生成的水蒸气;
(3)因SO2和CO2都能使石灰水变浑浊,因此要想检验出C02,就要先把SO2检验了,并除掉SO2,这样石灰水变浑浊才能说明有CO2,所以高锰酸钾溶液是吸收二氧化硫的作用,
故答案为:除去混合气体中的SO2;
(4)②中两次用到品红溶液,品红溶液A检验生成的SO2气体,通过酸性高锰酸钾溶液除去SO2,品红溶液B验SO2是否除尽,
故答案为:检验生成的SO2气体;检验SO2是否除尽;
(5)③是检验二氧化碳气体存在的实验装置,反应的离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O,反应现象是生成白色沉淀;
故答案为:出现白色沉淀;
(6)盛酸性高锰酸钾溶液的洗气瓶中发生反应的离子方程式是:5SO2+MnO4-+2H2O=2Mn2++5SO42-+4H+,
故答案为:5SO2+MnO4-+2H2O=2Mn2++5SO42-+4H+.
点评 本题考查物质检验实验方案的设计,侧重分析与实验能力的考查,关键是排除干扰、理解检验的顺序.

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案(1)用标准盐酸滴定未知浓度的NaOH溶液,下列情况会造成测定结果偏高的是CD (填选项字母).
A.滴定终点读数时,俯视滴定管刻度,其他操作正确
B.盛装NaOH溶液的锥形瓶用蒸馏水洗过,未用NaOH溶液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O
滴定数据如表:
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
②该草酸溶液的物质的量浓度为0.2 mol•L-1.
(3)沉淀滴定要求滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
参考表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是D(填选项字母).
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
| A. | 1,2─二甲基戊烷 | B. | 2─乙基戊烷 | C. | 2,3─二甲基戊烷 | D. | 3─甲基己烷 |
| A. | 浓硫酸 | B. | 浓盐酸 | C. | 硫酸铜 | D. | 稀硫酸 |
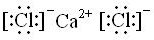 ,属于离子化合物.
,属于离子化合物. .
.


