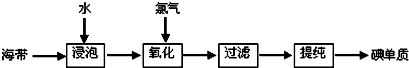
题目内容
一定条件下,充分燃烧一定量的丁烷放出热量161.9kJ,经测定完全吸收生成的CO2需消耗5mol/L的KOH溶液100ml,恰好生成正盐,则此条件下热化学方程式:C4H10(g)+
O2(g)→4CO2(g)+5H2O(g)的△H为( )
| 13 |
| 2 |
| A、+2590.4kJ/mol |
| B、-2590.4kJ/mol |
| C、+1295.2kJ/mol |
| D、-1295.2kJ/mol |
考点:热化学方程式
专题:化学反应中的能量变化
分析:充分燃烧一定量的丁烷发生的反应为:2C4H10+13O2
8CO2+10H2O,CO2恰好与KOH溶液完全反应生成正盐为K2CO3,2KOH+CO2═K2CO3+H2O,根据n=c×V计算KOH的物质的量,根据钾元素守恒计算n(K2CO3),根据碳元素守恒有n(CO2)=n(K2CO3),据此计算判断.
| 点燃 |
解答:
解:KOH的物质的量为n(KOH)=c×V=0.1L×5mol/L=0.5mol,2KOH+CO2═K2CO3+H2O,
根据钾离子守恒,故n(K2CO3)=0.5mol×
=0.25mol,根据碳元素守恒由n(CO2)=n(K2CO3)=0.25mol,
C4H10+
O24CO2+5H2O,根据碳元素守恒可知,丁烷的物质的量为n(C4H10)=0.25mol×
=
mol,
即
mol丁烷放出的热量大小为161.9kJ,故1mol丁烷完全燃烧放出的热量为161.9kJ×16=2590.4KJ,则此条件下反应热化学方程式为:C4H10(g)+
O2(g)═4CO2(g)+5H2O(g)△H=-2590.4 kJ?mol-1,
故选B.
根据钾离子守恒,故n(K2CO3)=0.5mol×
| 1 |
| 2 |
C4H10+
| 13 |
| 2 |
| 点燃 |
| 1 |
| 4 |
| 1 |
| 16 |
即
| 1 |
| 16 |
| 13 |
| 2 |
故选B.
点评:本题考查反应热的计算,根据氢氧化钾确定丁烷的物质的量是解答该题的关键,题目难度中等.

练习册系列答案
相关题目
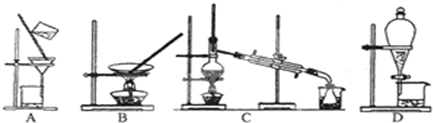
下列实验操作正确的是( )
A、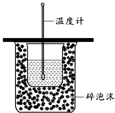 用如图装置测定中和热 |
| B、中和滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化 |
| C、研究H+浓度对该平衡:Cr2O72-+H2O?2CrO42-+2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸 |
| D、测定溶液的pH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照 |
下列说法中,错误的是( )
| A、乙烯的加成反应和乙烯使酸性KMnO4溶液褪色,都与分子内含有的碳碳双键有关 |
| B、用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷 |
| C、乙烯的化学性质比乙烷活泼 |
| D、相同质量的乙烯和甲烷完全燃烧后生成水的质量相同 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量可向盐酸中加入适量的( )
| A、NaOH(固体) |
| B、NaNO3 (固体) |
| C、NH4Cl(固体) |
| D、CH3COONa(固体) |
下列实验操作中正确的是( )
| A、为了节约火柴,用燃着的酒精灯引燃另一盏酒精灯 |
| B、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水的大 |
| C、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| D、蒸馏操作时,应使用温度计水银球应放到溶液中测量溶液的温度 |
下列括号中的物质是除去杂质所需的药品,其中错误的是( )
| A、NaCl中有杂质Na2SO4(氯化钡) |
| B、FeSO4中有杂质CuSO4(铁粉) |
| C、KCl溶液中有少量K2CO3(硫酸) |
| D、CO2中有少量CO(灼热的氧化铜) |