题目内容
1.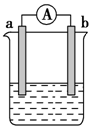 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:(1)当电极a为Al,电极b为Cu,电解质溶液为浓硝酸时,正极的电极反应式为:2H++NO3-+e-═NO2↑+H2O.
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的正极为Mg,负极的电极反应式为:Al+4OH--3e-═AlO2-+2H2O,当反应中收集到标准状况下448mL气体时,消耗的电极质量为0.36 g.
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所产生的能量直接转化为电能.现设计一燃料电池,以电极a为正极,电极b为负极,乙醇(C2H5OH)为燃料,采用氢氧化钠溶液为电解液,则乙醇应通入b极(填“a”或“b”),该电极的电极反应式为:C2H5OH+16OH--12e-═2CO32-+11H2O.
分析 (1)Al、Cu、浓硝酸构成的原电池,Al在浓硝酸中钝化,Cu能和浓硝酸反应,Cu被氧化,作负极,硝酸根得电子被还原为二氧化氮;
(2)Al、Mg、NaOH溶液构成的原电池中,Al为负极,Mg为正极,负极上Al失去电子,正极上水中的氢离子得到电子;
(3)燃料电池中,燃料通入负极失电子发生氧化反应.
解答 解:(1)Al在浓硝酸中钝化,硝酸根在正极铝上得电子被还原为二氧化氮,电极反应式为2H++NO3-+e-═NO2↑+H2O,
故答案为:2H++NO3-+e-═NO2↑+H2O;
(2)Al可与NaOH溶液发生氧化还原反应,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,则Al为负极,Mg为正极,负极上Al失去电子,电极反应为Al+4OH--3e-═AlO2-+2H2O;当反应中收集到标准状况下448mL即0.02mol气体时,
2Al+2OH-+2H2O=2AlO2-+3H2↑
54g 3mol
m(Al) 0.02mol
则消耗的电极Al的质量为:m(Al)=$\frac{0.02}{3}$×54g=0.36g,
故答案为:Mg;Al+4OH--3 e-═AlO2-+2H2O,0.36;
(3)乙醇燃料电池中,通入燃料的电极是负极,则乙醇应通入b极,在碱性环境中乙醇失电子产生碳酸根和水,电极反应式为C2H5OH+16OH--12e-═2CO32-+11H2O,
故答案为:b;C2H5OH+16OH--12e-═2CO32-+11H2O.
点评 本题考查原电池的工作原理,为高频考点,侧重于考查学生的分析能力和应用能力,注意(2)中不能直接利用金属活泼性判断负极,应从氧化还原反应的角度考虑,题目难度不大.

 习题精选系列答案
习题精选系列答案| A. | 食盐和醋可作调味剂,也可用作食品防腐剂 | |
| B. | 植物秸秆不可用来制造酒精 | |
| C. | 镁合金可用于制造火箭、导弹和飞机的部件 | |
| D. | 二氧化硅可用于制光导纤维 |
| A. | Ba(HCO3)2、Al(NO3)3 | B. | CaCl2、NaHCO3 | C. | Al2(SO4)3、NaOH | D. | Na2CO3、CuSO4 |
| A. | ${\;}_{118}^{78}$Pt | B. | ${\;}_{78}^{118}$Pt | C. | ${\;}_{78}^{196}$Pt | D. | ${\;}_{118}^{196}$Pt |
| 选项 | 实验目的 | 实验操作 |
| A | 制备乙炔时,减缓乙炔的生成速率 | 用饱和食盐水替代水跟电石反应 |
| B | 证明NH4Cl溶液能促进Mg(OH)2固体的溶解 | 向两份等量的Mg(OH)2固体中分别加入等体积的蒸馏水和NH4Cl溶液 |
| C | 验证乙醇发生消去反应生成乙烯 | 将生成的气体直接通入含Br2的CCl4溶液中 |
| D | 证明Al2O3的熔点比Al高 | 把砂纸打磨过的铝箔在酒精灯上加热至熔化 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 明矾易水解生成胶体,可用作净水剂 | |
| B. | 晶体硅熔点高硬度大,可用作芯片 | |
| C. | 氮气化学性质稳定,可用作粮食保护气 | |
| D. | NaClO具有强氧化性,可作织物漂白剂 |
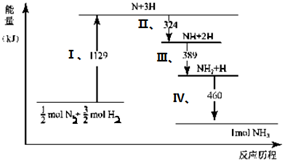
| A. | Ⅰ中1129 kJ为该反应过程的活化能 | |
| B. | N2(g)+3H2 (g)?2NH3 (g)△H=2(324+389+460-1129)kJ/mol | |
| C. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | |
| D. | N2(g)+3H2 (g)?2NH3 (g)△H>0 |
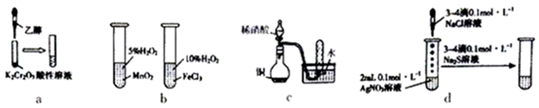
| A. | a图,滴加乙醇,试管中橙色溶液变为绿色,乙醇发生取代反应生成乙酸 | |
| B. | b图,左边试管中产生气泡迅速,说明二氧化锰的催化效果比氯化铁好 | |
| C. | c图,根据试管中收集到无色气体,能验证铜与稀硝酸的反应产物是NO | |
| D. | d图,试管中先有白色沉淀,后有黑色沉淀生成,能确定Ksp(AgCl)>Ksp(Ag2S) |