题目内容
9.将4mol A气体和2mol B气体在2L固定体积的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)?2C(g).若经2s后测得C的浓度为0.6mol•L-1,现有下列几种说法,其中正确的是( )| A. | 用物质A表示的反应的平均速率为0.6 mol•(L•s)-1 | |
| B. | 2 s时物质B的浓度为1.4 mol•L-1 | |
| C. | 2 s时物质A的转化率为70% | |
| D. | 2 s时物质A的体积分数为$\frac{14}{27}$ |
分析 将 4mol A气体和 2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)?2C(g),若经 2s(秒)后测得C的浓度为0.6mol•L-1,依据化学平衡三段式列式计算
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s末(mol) 2.8 1.4 2L×0.6mol/L=1.2mol,
据此结合反应速率、物质的量浓度、转化率、体积分数的表达式对各选项进行判断.
解答 解:将 4mol A气体和 2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)?2C(g),若经 2s(秒)后测得C的浓度为0.6mol•L-1,依据化学平衡三段式列式计算
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s末(mol) 2.8 1.4 2L×0.6mol/L=1.2mol,
A.用物质A表示的反应的平均速率为:$\frac{\frac{1.2mol}{2L}}{2s}$=0.3mol•(L•s)-1,故A错误;
B.2s时物质B的浓度为:$\frac{1.4mol}{2L}$=0.7 mol•L-1,故B错误;
C.2s时物质A的转化率为:$\frac{1.2mol}{4mol}$×100%=30%,故C错误;
D.相同条件下气体的体积分数等于其物质的量分数,则2s时物质A的体积分数为:$\frac{2.8mol}{2.8mol+1.4mol+1.2mol}$=$\frac{14}{27}$,故D正确;
故选D.
点评 本题考查了化学平衡的计算,题目难度中等,涉及反应速率、转化率、体积分数、物质的量浓度的计算,注意掌握三段式在化学平衡计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

| A. | 先加入酸性高锰酸钾溶液;加稀硝酸酸化后加银氨溶液,微热 | |
| B. | 先加入溴水;加稀硝酸酸化后加酸性高锰酸钾溶液 | |
| C. | 先加入新制氢氧化铜悬浊液,加热;加稀硝酸酸化,再加入溴水 | |
| D. | 先加入银氨溶液;再另取该物质加入溴水 |
| A. | 元素W与氢形成原子比为1:1的化合物有多种 | |
| B. | 元素X的单质能与水、无水乙醇反应 | |
| C. | 离子Y3+与Z-的最外层电子数和电子层数都不相同 | |
| D. | 元素W与元素Z可形成含有极性共价键的化合物 |
| A. | 56g Fe与稀HNO3完全反应时一定转移3NA个电子 | |
| B. | 标准状况下11.2 L NH3溶于1 L水中,溶液中含N原子的微粒总数为0.5NA | |
| C. | 常温常压下,0.1NA个Al与足量氢氧化钠溶液反应生成3.36 LH2 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
| A. | Na+、Cl-、HCO3-、Ca2+ | B. | OH-、Na+、Mg2+、HCO3- | ||
| C. | Na+、Cl-、H+、Ag+ | D. | Na+、SiO32-、H+、Cl- |
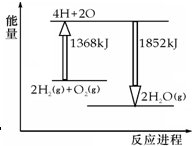
| A. | 拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子,共吸收1368kJ能量 | |
| B. | 由H、O原子形成2molH2O(g),共放出1852kJ能量 | |
| C. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共吸收484kJ能量 | |
| D. | 2molH2(g)和1molO2(g)反应生成2molH2O(l),放出热量大于484kJ |
 .
.