题目内容
1.如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法不正确的是( )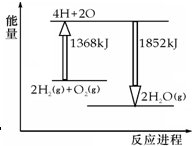
| A. | 拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子,共吸收1368kJ能量 | |
| B. | 由H、O原子形成2molH2O(g),共放出1852kJ能量 | |
| C. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共吸收484kJ能量 | |
| D. | 2molH2(g)和1molO2(g)反应生成2molH2O(l),放出热量大于484kJ |
分析 A.依据图象数据结合拆化学键吸收能量分析;
B.依据图象数据结合形成化学键放出能量分析;
C.氢气和氧气反应放热;
D.依据反应焓变=反应物化学键键能总和-生成物化学键键能总和,聚集状态从气态变为液态放热.
解答 解:A.拆化学键吸收能量,由图可知:拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子,共吸收1368kJ能量,故A正确;
B.形成化学键放出能量,右图可知:由H、O原子形成2molH2O(g),共放出1852kJ能量,故B正确;
C.氢气和氧气反应放热;焓变小于0,即为放热反应,故C错误;
D.依据图象数据分析计算,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 kJ能量,生成2molH2O(l),放出热量大于484kJ,故D正确;
故选C.
点评 本题考查了反应能量变化,图象分析数据计算应用,题目难度不大.

练习册系列答案
相关题目
9.将4mol A气体和2mol B气体在2L固定体积的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)?2C(g).若经2s后测得C的浓度为0.6mol•L-1,现有下列几种说法,其中正确的是( )
| A. | 用物质A表示的反应的平均速率为0.6 mol•(L•s)-1 | |
| B. | 2 s时物质B的浓度为1.4 mol•L-1 | |
| C. | 2 s时物质A的转化率为70% | |
| D. | 2 s时物质A的体积分数为$\frac{14}{27}$ |
16.下列表示方法正确的是( )
①CH4分子的比例模型:
②四氯化碳分子的电子式为: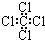
③乙烯的结构简式 CH2CH2
④丙烷分子的球棍模型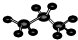
①CH4分子的比例模型:

②四氯化碳分子的电子式为:
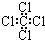
③乙烯的结构简式 CH2CH2
④丙烷分子的球棍模型

| A. | ①④ | B. | ①②④ | C. | ①②③④ | D. | ②③ |
6.对K2CO3分类,不正确的是( )
| A. | 属于钾盐 | B. | 属于碳酸盐 | C. | 属于正盐 | D. | 属于酸式盐 |
13.下列物质中一定互为同系物的是( )
| A. | CH2=CH2和CH2=CH-CH=CH2 | B. | C4H8和C6H12 | ||
| C. | 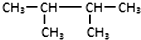 和(CH3)2CHCH(CH3)2 和(CH3)2CHCH(CH3)2 | D. | C2H6和C4H10 |
11.下列有关物质性质的说法错误的是( )
| A. | 非金属性:Cl>I | B. | 碱性:KOH>NaOH | ||
| C. | 酸性:H2SO3>H2SO4 | D. | 结合H+能力:CO32->Cl- |

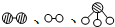 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中化学键断裂.
 .
. .
.